摘要
背景
细菌性脑膜炎是一种危及生命的疾病,当病原体如脑膜炎奈瑟氏菌穿过脑膜血脑脊液屏障(mBCSFB)感染脑膜。beplay靠谱由于人类特有的性质脑膜炎奈瑟菌在此之前,研究这种复杂的宿主-病原体相互作用的研究大多是在体外单独使用永生化脑内皮细胞(BECs)进行的,这些细胞在培养中通常不保留相关的屏障特性。在这里,我们建立了生理学相关的mBCSFB模型,使用BECs与瘦脑膜细胞(LMCs)共培养进行检测脑膜炎奈瑟菌交互。
方法
我们使用来自诱导多能干细胞(iBECs)的bec样细胞或hCMEC/D3细胞与来自肿瘤活检的LMCs共培养。我们采用透射电镜和结构照明显微镜来表征模型以及细菌相互作用。我们测量了TEER和荧光素钠(NaF)的渗透性,以确定屏障的密封性和完整性。然后,我们分析了细菌的粘附和细胞屏障的渗透,并检查了宿主基因表达的变化,紧密连接以及趋化因子和细胞因子对感染的反应。
结果
两种细胞类型在共培养中保持不同,iBECs显示出BEC标记物的特征表达,包括紧密连接蛋白和内皮标记物。通过TEER和NaF通透性测定的iBEC屏障功能在LMC共培养后得到改善,并保持7天的稳定。BEC对脑膜炎奈瑟菌LMC共培养对感染无影响。我们检测到相当数量的bc粘附脑膜炎球菌和相对少量的细胞内细菌。有趣的是,我们发现细菌在感染后的第一个24小时内穿过bc - lmc屏障,当时屏障的完整性仍然很高,这表明了一种跨细胞途径脑膜炎奈瑟菌进入中枢神经系统。最后,我们观察到屏障特性的恶化,包括TEER的丧失和细胞连接成分在感染后期的表达减少。
结论
在这里,我们首次报道了人类iPSC衍生的BECs或hCMEC/D3与脑膜瘤衍生的LMCs共培养,并发现LMC共培养改善了iBECs的屏障特性。这些新颖的模型可以让我们更好地理解脑膜炎奈瑟菌mBCSFB在生理相关环境中的相互作用。
背景
细菌性脑膜炎是一种毁灭性疾病,由细菌性感染引起的脑膜炎症所定义[1,2]。尽管努力接种疫苗,人类特有的革兰氏阴性细菌脑膜炎奈瑟氏菌(Nm,脑膜炎球菌)仍然是全球细菌性脑膜炎的主要病因之一[3.,4,5]。根据年龄和其他危险因素,高达35%的健康人群无症状地在鼻咽部定植病原体[6]。脑膜炎奈瑟菌可穿过鼻咽上皮屏障,经血液系统传播,并引起侵袭性脑膜炎球菌病(IMD),如败血症和/或脑膜炎[7]。虽然可以用现代抗生素治疗,但全身性脑膜炎球菌感染仍与神经系统后遗症和死亡率有关[1,2]。
脑膜炎球菌性脑膜炎发病机制的一个关键步骤是穿越脑膜血-脑脊液屏障(mBCFSB)并随后与轻脑膜细胞(lmc)相互作用[beplay靠谱8,9]。血液-中枢神经系统(CNS)屏障,如血脑屏障(BBB)和mBCSFB是由高度特化的脑内皮细胞(BECs)组成的,它们通过促进营养物质的运输和限制毒素、药物和病原体的通过来维持CNS的稳态[1]。与外周内皮细胞相比,BECs特有的主要表型之一是复杂粘附物和紧密连接的存在,这些粘附物和紧密连接使相邻细胞膜之间的空间最小化,并防止细胞旁物质进入中枢神经系统[10,11]。mBCSFB的BECs构成血管,这些血管流经脑膜之间充满csf的空间,例如蛛网膜下腔[8,9,12]。与血脑屏障不同,血脑屏障的BECs被神经血管单位的细胞,即星形胶质细胞和周细胞所包围[10,11], mBCSFB的BECs被组成蛛网膜和脑脊液的lmc片所包围和包围[8]。
脑膜炎奈瑟菌由于病原体的人类特异性,主要使用永生化ec和体外BECs来评估与BECs的相互作用(参见[13])。先前的研究已经确定了几个对BECs粘附和侵袭很重要的毒力因子,如iv型菌毛(Tfp)、不透明蛋白OpcA和Opa,以及一系列次要的粘附或粘附样蛋白(如粘附蛋白复合体蛋白、Neisserial粘附蛋白a、奈瑟氏菌属此外,还发现了相应的结合宿主细胞受体,如CD147和α5β1/αvβ3整合素[14,15,16,17,18,19,20.,21,22]。在这些细胞感染后,对BECs中细胞骨架以及细胞膜和连接成分的信号通路和重排的影响已经详细描述脑膜炎奈瑟菌(14,15,16,18,23,24,25,26,27,28]。
最后,研究人员提出了脑膜炎球菌穿越BEC屏障的两种主要途径,第一种途径是由细菌粘附素/侵入素与细胞受体的紧密相互作用以及在细菌周围形成微绒毛样结构后的囊泡摄取引起的细胞内或细胞外途径[17,18,27,29,30.,31,32]。细胞间或细胞旁交叉脑膜炎奈瑟菌几项研究表明,由于细胞连接成分的重排、降解或下调,细菌感染会损害屏障的完整性[15,25,28,33]。
关于随后脑膜炎球菌穿过包裹血管内皮的LMC薄片的情况知之甚少脑膜炎奈瑟菌与蛛网膜和脑膜的lmc相互作用。以前的研究已经确定了细菌因素导致脑膜炎奈瑟菌-LMC相互作用,如Tfp,表征了lmc对感染的炎症反应[34,35,36,37]。在这些研究中,使用了来自脑膜瘤的lmc,这些lmc已被证实用于感染研究脑膜炎奈瑟菌及其他中枢神经系统的细菌病原体[8,34,35,36,37,38,39]。
到目前为止,研究脑膜炎奈瑟菌mBCSFB的相互作用主要利用永生化BECs的单培养,这些BECs不保留关键的血脑屏障表型,如高屏障紧密性[11,40,41]。尽管一些研究表明,与其他类型的中枢神经系统细胞共培养能够改善屏障表型,但诸如跨内皮电阻(TEER)等定义可测量值仍然相对较低[11,40,41]。永生化微血管内皮细胞系hCMEC/D3是一种强大且广泛应用的体外模型脑膜炎奈瑟菌-BEC相互作用,尽管可能缺乏一些关键的BEC表型[14,15,16,42,43]。
干细胞技术的最新进展已经产生了来自人诱导多能干细胞(iPSCs)的BECs样细胞模型,该模型更好地反映了BECs的屏障表型[11,44,45]。iPSC衍生的BECs (iBECs)表现出BBB标记物(如粘附物和紧密连接成分)的特征性表达,表现出高TEER,并对与其他中枢神经系统细胞类型共培养有反应[11,40,44,45,46,47,48,49]。最近,iBEC单一培养模型已被证实用于脑膜炎病原体的感染研究链球菌agalactiae(B组链球菌)[50,51,52],我们已经开始使用iBECs单一文化模型来研究它们与脑膜炎奈瑟菌(33,46]。此外,该模型也被用于检查嗜神经性病毒病原体[53,54]。然而,据我们所知,在mBCSFB中与其他中枢神经系统细胞类型共培养对宿主-病原体相互作用的影响尚未得到评估。
在这里,我们报道了利用诱导多能干细胞衍生的BECs与脑膜瘤衍生的LMCs共培养的人类mBCSFB生理相关体外模型的发展脑膜炎奈瑟菌交互。同时,我们以建立的感染模型细胞系hCMEC/D3为参考,建立了becc - lmc共培养模型。
方法
细胞培养
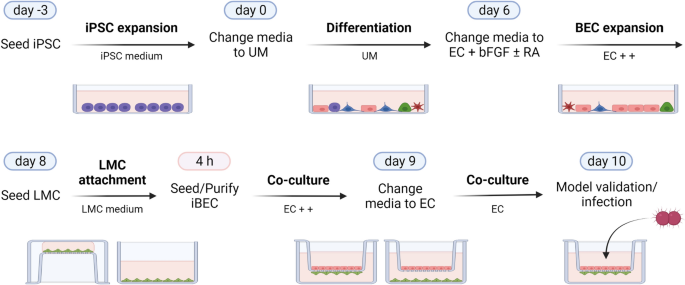
人诱导多能干细胞(iPSC)系IMR90-4 (WiCell)保存在StemFlex培养基(Gibco)的Matrigel(康宁)涂覆的6孔板(Sarstedt)上,每周传代两次,每天更换培养基,如前所述[33,44,45,46,48]。脑膜上皮组织学亚型的脑膜瘤细胞来源于肿瘤活检,其特征与先前描述的一致[36]。脑膜瘤细胞在DMEM + GlutaMAX (Gibco)培养基中生长,添加10% FCS (Gibco)和1% Pen/Strep (Gibco),每周传代2次,种子密度为4 × 103.细胞/厘米2。细胞被扩增并用于实验直到传代10或直到显示衰老的迹象。hCMEC/D3细胞(Sigma, SCC066)在EndoGRO-MV完全培养基(Sigma)中培养,根据需要进行分裂。hCMEC/D3和脑膜瘤细胞生长在30µg/ml胶原蛋白1(大鼠尾巴,Gibco)包被的组织培养瓶上。
诱导多能干细胞生成脑内皮样细胞
ipsc衍生的脑微血管内皮样细胞(iBECs)分化如先前所述[33,44,45,46,48]。简单地说,将iPSCs从单细胞悬液中以1 × 10的密度接种到Matrigel包被细胞培养瓶(Sarstedt)上4细胞/cm2,在StemFlex培养基中扩增3天,每天更换培养基。iPSC扩增后,细胞在无条件培养基中分化[UM;DMEM/F-12 (Gibco), 20%基因剔除血清替代(Gibco), 1%最低必需培养基-非必需氨基酸(Gibco), 0.5%谷氨酰胺(Gibco)和0.07% β -巯基乙醇(Sigma)],每天更换培养基。6天后,将培养基改为基本EC培养基[人内皮细胞无血清培养基(Gibco)和1%血小板缺乏血浆衍生血清(Fisher)或1% B-27补充剂(Gibco)],添加20 ng/ml碱性成纤维细胞生长因子(bFGF, ReproTech)和10 μM全反式维甲酸(RA, Sigma),持续2天。最后,将分化的iBECs纯化到IV型胶原蛋白(Sigma)和纤维连接蛋白(Sigma)包被板和transwell插入物(Corning;他一一)。iBEC纯化后1天去除碱性成纤维细胞生长因子和维甲酸。通过TEER测量和特征BEC标记物的免疫荧光染色来评估分化iBECs的质量。
BECs与薄脑膜细胞共培养
在iBEC分化的第8天,以3.6 × 10的密度播种脑膜瘤细胞4细胞/厘米2在transwell插入物的底部[0.4µm插入物(康宁)或3µm插入物(Greiner)],顶部涂覆胶原IV和纤维连接蛋白,底部涂覆150µg/ml胶原1(大鼠尾,Gibco)(直接共培养)。间接共培养为2.2 × 104细胞/厘米2接种于胶原蛋白1包被的细胞培养板上,随后加入胶原蛋白IV和纤维连接蛋白包被的transwell插入物。在37℃和5% CO条件下孵育4小时后2将transwell插入物翻转到指定的孔中,在transwell膜上纯化iBECs,以大约9 × 10的密度播种分化细胞5细胞/厘米2到IV型胶原和纤维连接蛋白基质上在含Pen/Strep的EC培养基中共培养1天,然后换为不含bFGF和RA的基本EC培养基。共培养第2天(即iBEC分化方案第10天)进行实验。对于hCMEC/D3细胞和脑膜瘤细胞的共培养,transwell插入物完全包被150µg/ml胶原1。脑膜瘤细胞按照iBEC模型的描述进行播种。4 h后,将hCMEC/D3细胞以9 × 10的密度接种于膜上4细胞/平方厘米。在EndoGRO培养基中共培养3天后进行实验。
菌株
脑膜炎奈瑟氏菌血清B组菌株mc58 -序列型(ST)-74 [ST-32克隆复合体(cc)],由e.r. Moxon [55-在这项研究中使用。在哥伦比亚琼脂上添加5%羊血(biomacimrieux),在37℃和5% CO条件下培养脑膜炎球菌2过夜。第二天,细菌传代于新鲜添加1%家乐氏培养基(10 nM MgCL)的液体蛋白酶蛋白胨培养基(PPM)中2和10nm NaHCO3.(罗斯)-在37°C和200转60至90分钟。
感染分析
在进行感染实验前一天,用Dulbecco的磷酸盐缓冲盐水(DPBS, Gibco)洗涤两次,从细胞共培养培养基中去除抗生素。培养基在感染当天更换一次,至少在加菌前1小时更换。细菌感染细胞的制备方法如前所述[33,46,56]。在液体传代培养中培养的细菌在感染前被纺丝,在DPBS中洗涤,并在细胞培养基中稀释。除非另有特别说明,否则使用感染多重数(MOI)为10。
庆大霉素保护试验
利用庆大霉素保护试验评估细菌对模型内皮细胞层的粘附和侵袭。BEC层感染脑膜炎奈瑟菌MC58菌株2 h或8 h, MOI为100,这在先前发表的研究病原体与BECs相互作用的MOI范围内[15,16,24,32,57]。为了在感染后的指定时间内计数每个单层细胞内的CFU,用DPBS洗涤细胞一次,并在含有200µg/ml庆大霉素(Biochrom)的细胞培养基中再孵育2小时。为了评估细胞相关细菌的总数,在指定的时间点立即处理样品。简单地说,用0.05%胰蛋白酶- edta (Gibco)在37℃下分离和裂解5分钟,在室温(RT)下用1%皂苷(SERVA)分离和裂解15分钟。样品在稀释系列中镀,细菌数量由可计数稀释的CFU计数计算。数据以回收的CFU总量/单层表示。
轮回分析
细菌迁移率是通过枚举在每个指定时间点后一小时内从模型的根尖迁移到基底外侧室的CFU来确定的,使用类似于前面描述的方法[33]。使用孔径为3µm的Transwell插入物(Greiner)确保脑膜炎球菌可以通过膜。插入物在PBS中洗涤两次,然后转移到新鲜培养基中,只更换底部的培养基。在37℃和5% CO条件下孵育1小时后2从底侧培养基中提取样品,进行稀释,以确定细菌载量。
TEER和渗透率实验
屏障严密性通过使用伏特-欧姆计(Millicell ERS-2,默克)和荧光素钠(NaF)渗透性测量的跨内皮电阻(TEER)进行评估,如前所述[48]。简单地说,将transwell插入物顶部的培养基替换为10µM NaF (Sigma),每隔15分钟从基底侧培养基中取样品,持续1小时。在最后时间点,从顶部隔间中收集额外的样品,所有样品在荧光板阅读器(Tecan)中进行分析,并按前面所述计算NaF渗透率(Pe) [48]。
免疫荧光
共培养模型的免疫荧光染色采用先前描述的iBEC和LMC染色方案[36,46,48]。将transwell插入物上的细胞在冰冷的甲醇中固定15分钟,用DPBS洗涤,并在10% FCS中rt孵育1小时。为了检测上皮膜抗原(EMA/Mucin 1)和E-Cadherin,将细胞固定在4%多聚甲醛中,并用含有0.1%皂苷的10% FCS阻断。用手术刀切除Transwell膜,将其转移到细胞培养板的孔中,在4°C下过夜进行一抗染色(表2)1).第二天,在DPBS中洗涤样品,并使用Alexa Fluor 488山羊抗小鼠(Invitrogen,参考文献A11001)和Alexa Fluor 555驴抗兔(Invitrogen,参考文献A31572)抗体在10% FCS中稀释1:20 00,在RT下进行二次染色1小时。经过最后的洗涤步骤和DAPI染色(Invitrogen,参考文献D1306;1:5000 (DPBS),将膜安装在载玻片上(安装介质:Fluoroshield, Sigma),在Eclipse T上观察细胞染色我2 .共聚焦显微镜(尼康)。使用NIS Elements图像软件5.02版(尼康)进行图像采集和分析。使用JAnaP结分析程序确定occludin表达的结覆盖率[58]。
超分辨率显微镜
表达gfp的野生型菌株MC58感染24 h后[26]、iBEC-LMC和hCMEC/D3-LMC体外共培养模型在DPBS中洗涤一次,在细胞骨架缓冲液(10 mM MES、150 mM NaCl、5 mM EGTA、5 mM葡萄糖和5 mM MgCl)中渗透2调整pH值6.11)与0.25%戊二醛(σ)和0.25% Triton x - 100(罗斯)1 - 2分钟37°C,以及细胞骨架固定在缓冲2%戊二醛在rt,样本为10分钟洗两次,淬火硼氢化钠在0.1%(σ)在PBS 7分钟后沿第三洗涤步骤,transwell膜被切断,沾染了5 U /毫升phalloidin-Alexa萤石543(表达载体,裁判A22283)或100 nM phalloidin-ATTO 643 (ATTO-Tec ref。ad643 - 81)在一夜之间在4°C。第二天,样品用DAPI染色(Invitrogen,编号D1306;1:5000 (DPBS),并在ddH中洗涤2将Transwell膜切成两半并安装在extend中™玻璃防褪色贴片(TermoFisher)在清洁的高精度覆盖玻璃载玻片(BRAND)上,膜的一半是内皮细胞的一面,另一边是脑膜细胞的一面。安装的样品在室温下固化过夜,然后在4°C下保存。
结构照明显微镜(SIM)在蔡司Elyra 7上进行2使用40x (Plan-Apochromat 40x/1.4 Oil DIC M27)或63x (Plan-Apochromat 63x/1.4 Oil DIC M27)油浸物镜和四种不同的激发激光器(405 nm二极管,488 nm OPSL, 561 nm OPSL和642nm二极管激光器)。使用适当的带通和长通滤波器,以3D Leap模式捕获内皮细胞或脑膜细胞层的z堆叠,并采用最佳z步长,由压电级控制。通过晶格SIM图的9或13个相移进行SIM成像。使用ZEN 3.0 SR FP2(黑色)(Version 16.0.10.306;蔡司)与SIM卡和SIM卡2处理模块。使用Imaris 9.2.1对最终图像进行处理。(Bitplane)。
透射电子显微镜
在感染后的指定时间点制备样品进行透射电子显微镜(TEM)检查。Transwell膜在DPBS中洗涤,在2.5%戊二醛(Sigma)中固定1小时,在室温下,在50 mM cacodyate缓冲液(Roth)中洗涤三次,用手术刀切除,转移到含有cacodyate缓冲液的玻璃瓶中进行进一步处理。样品已按先前公布的[59],并进行如下修改:将样品浸润并包埋于Durcupan (Sigma)中。电子显微图记录在配备Matataki相机系统的JEM-1400Flash透射电子显微镜(JEOL)上。
RNA提取和定量PCR
在与细菌孵育指定时间后,使用Accutase (Sigma)分离15 min (iBEC)或5-7 min (hCMEC/D3)收集transwell模型的细胞。未感染的细胞作为对照。使用NucleoSpin RNA试剂盒(Machery-Nagel)进行细胞裂解和RNA纯化。利用LunaScript RT (New England BioLabs)生成cDNA。采用PowerUp SYBR Green主混合物(Applied Biosystems),在StepOnePlus实时荧光定量PCR热循环仪(Applied Biosystems)上进行定量PCR (qPCR)。引物序列见表2。通过引物效率分析和琼脂糖凝胶电泳对qPCR产物进行验证。qPCR数据以折线变化的形式呈现18岁使用周期阈值(ΔΔC)t)计算[60]。
SNAI1基因敲除实验
使用TransIT-siQUEST转染hCMEC/D3细胞siRNA®转染试剂(阴性)根据制造商的说明。hCMEC/D3以2 × 10的密度播种5在转染前一天将细胞/孔移植到24孔板上。SNAI1将终浓度为50 nM的siRNA (Santa Cruz)或经过FITC修饰的siRNA (Santa Cruz)加入到EndoGRO基础培养基(50µl/孔)和TransIT-siQUEST®转染试剂(1.5µl/孔)的混合物中,在RT下孵育30分钟后转染。转染24 h后,更换培养基,细胞层感染脑膜炎奈瑟氏菌血清B组MC58在MOI为10的条件下孵育24 h。最后,收集细胞裂解液进行qPCR分析。为了评估细胞活力,收集整个细胞,在PBS中洗涤,用1 mg/ml碘化丙啶(PI)染色10分钟,然后进行流式细胞术分析。未转染的细胞在PI染色期间分别用或不加2.5% Triton-X处理作为对照。
引发ELISA
在指定的细菌孵育时间后,从transwell模型中收集上清液,使用Human IL-8 ELISA Set (BD Biosciences)并按照制造商的说明进行IL-8的检测。简单地说,在4°C o/n下,96孔板(透明,平底)涂上捕获抗体(1:250,0.1 M碳酸钠,pH 9.5)。10% FCS在室温下阻断1h后,将样品和标准品在10% FCS中适当稀释,一式两份加入板中。在密封板中RT孵育2小时后,将检测抗体和链亲和素-辣根过氧化物酶偶联物(均为1:250,10% FCS) 1:1混合,RT孵育1小时。在所有上述步骤之间,使用0.05% Tween在PBS中进行多次洗涤。最后,用四甲基联苯胺和过氧化氢(Thermo Fisher)以1:1的比例在RT下孵育15-30分钟,然后用2h停止反应2所以4。波长校正吸光度(450nm - 570nm)使用吸收板阅读器(Tecan)测量,蛋白质浓度使用标准曲线计算。
统计数据
所有统计分析均采用GraphPad Prism版本6.01 (GraphPad Software Inc.)。在适当的情况下,使用双尾学生t检验进行两两比较。多重比较采用方差分析(ANOVA)和Dunnett多重比较检验。P值小于0.05时,认为有统计学意义。
结果
mBCSFB共培养模型的发展与表征
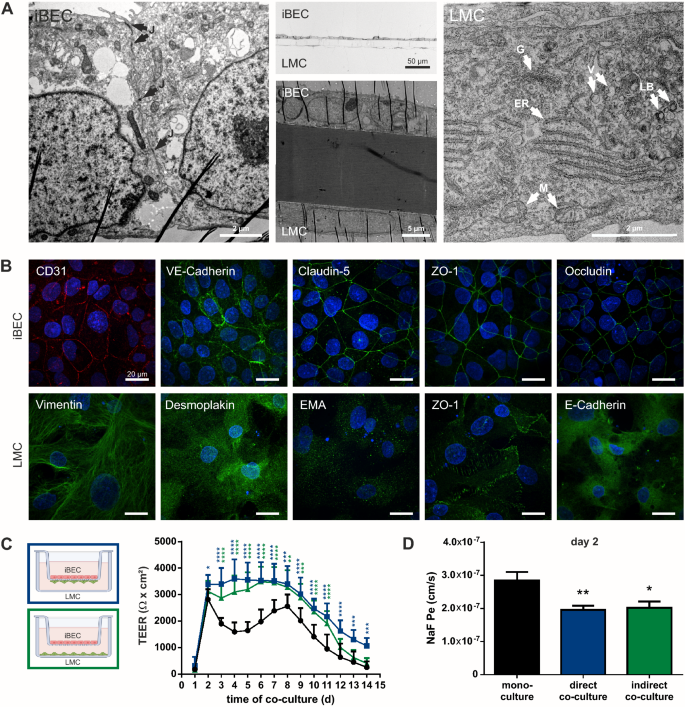
脑内皮样细胞(iBECs)根据先前描述的方案从iPSC系IMR90-4中分化出来[44,45,46,48]并与来源于脑膜瘤的模型轻脑膜细胞共培养[36], (lmc)纯化后立即放置两天(图2)。1).采用透射电镜(TEM)和共聚焦免疫荧光成像对共培养模型进行表征。在优化的播种密度下,透射电镜和半薄截面成像显示,跨井膜两侧的iBECs和LMCs单层形态不同(图2)。2a).通过透射电镜,我们观察到致密iBEC单层相邻细胞之间的各种电子密集区域,很可能代表细胞连接,包括紧密连接、粘附连接和桥粒(图2)。2a)。基底外侧的大得多的lmc显示出扩张性形态,长细胞突起延伸到其他细胞,通过透射电镜可以看到细胞质成分,包括高尔基体、内质网、囊泡、板层体和线粒体(图2)。2a).免疫荧光染色显示,脑内皮标志物如CD31、VE-cadherin以及紧密连接蛋白ZO-1、occludin和claudin-5在iBEC层内的细胞连接处的特征性表达(图2)。2b).除了ZO-1的明显表达外,在LMC层中未观察到这些标记(图2)。2b;额外的文件1:视频1)。在共培养中,脑膜上皮亚型的脑膜瘤衍生细胞保留了其特征形态和组织病理学标记物vimentin、desmoplakin和上皮膜抗原(EMA)的表达。2b).尽管E-Cadherin免疫阳性,据报道,E-Cadherin在形成蛛网膜屏障的小脑膜细胞中表达[64],这些细胞没有显示出蛋白质的连接定位。最后,由于目前的研究已经深入了解了细胞外基质对血脑屏障发育和成熟的重要性,特别是关注层粘连蛋白[65],我们对这类ECM蛋白的iBEC-LMC共培养模型进行了染色,并在transwell膜的两侧发现了表达(附加文件)2:图S1)。综上所述,这些结果表明iBECs可以与LMC细胞共培养,并且染色模式表明两种细胞类型保留了它们的特征并在培养中保持不同。
iBEC-LMC共培养模型的表征。一个在transwell上共培养2天的iBECs和LMCs的透射电镜(TEM)。除了超薄切片的电子显微图外,还展示了嵌入模型的半薄截面的宽视场图像(中间,顶部)。标记结构:细胞连接(J),高尔基体(G),粗内质网(ER),线粒体(M),囊泡(V),板层体(LB)。b共培养2天后,对跨井膜两侧的iBEC(上)和LMC(下)单层进行内皮粘附连接蛋白(CD31, VE-Cadherin),紧密连接成分(cludin -5, ZO-1, occludin, E-cadherin)和脑膜瘤标志物(vimentin, desmoplakin I/II,上皮膜抗原)的免疫荧光染色。DAPI染色细胞核(蓝色)。比例尺代表20µm。ciBEC单培养(黑色)、直接(蓝色)和间接(绿色)iBEC- lmc共培养14天的跨内皮电阻(TEER)。diBEC单一和共培养模型在共培养第2天的荧光素钠通透性(NaF Pe),根据先前描述的方案测定[48]。所有数据均以三个独立实验的平均值±SD表示,iBEC分化为三个重复(n = 9)。* * * p < 0.05, p < 0.01, * * * p < 0.001, * * * * p < 0.0001;方差分析采用Dunnett多重比较检验;直接(蓝色)和间接(绿色)共栽培vs单一栽培
作为参考,BEC- lmc共培养模型采用已建立的BEC细胞系hCMEC/D3 [42,43]是并行开发的,并使用相同的方法进行表征。共培养3天后,在transwell膜两侧观察到两种细胞类型的融合层,并检测到VE-Cadherin和ZO-1等BEC生成物的表达(另附文件)2:图S2a, b)。然而,在hCMEC/D3层中,我们无法实现细胞-细胞边界交界处BEC标记物的清晰和均匀的免疫荧光染色(附加文件)2:图S2b)。虽然据报道hCMEC/D3s可能缺乏某些屏障特性,如紧密连接组分的连续连接表达,但该模型确实保留了大部分BEC表型,特别是与其他人类原代或永生化细胞系相比,并且已被广泛用于研究脑膜炎奈瑟菌-BEC体外相互作用[11,14,15,16,28,41,42,43]。因此,我们在本研究中继续使用hCMEC/D3作为参考,首次报道了hCMEC/D3与lmc共培养的情况。
LMC共培养提高了BEC屏障的紧密性和稳定性
为了评估LMC共培养对iBEC模型屏障紧密性和完整性的影响,我们测量了跨内皮电阻(TEER)和荧光素钠(NaF)通透性。在iBEC纯化和共培养开始后的14天内进行TEER测量(第1天切换到EC培养基后没有更换培养基;即分化的第9天)。2c),并在指定天数测定NaF渗透率(图2)。2d和附加文件2:图S3b)。iBEC单培养和iBEC- lmc共培养的TEER水平均> 2000 Ω x cm2共培养的第2天[40(图。2c),对应于iBEC分化方案的第10天,此时iBEC单株培养通常达到峰值TEER [46,48]。同时,TEER升高(3389±354 Ω x cm)2NaF通透性降低(1.96±0.38 × 10)7cm/s),与iBEC单培养(2820±384 Ω x cm)相比2;2.85±0.73 × 107厘米/秒)(图2c, d)。之后,在直接和间接共培养中,TEER保持稳定,并显著提高了7天(图2)。2c).在transwell底部单独培养的LMC细胞产生的TEER不高于37±17 Ω x cm2TEER的增加继续伴随着NaF通透性的降低(第4天;额外的文件2:图S3)。iBEC单一培养的TEER在第2天达到峰值后下降,然后再次上升到接近峰值的水平,最后在第8天持续下降(图2)。2C),这与以前报告的数据相当[66]。从第8天开始,在与单一培养平行的两种共培养模型中也观察到TEER的持续降低。然而,间接共培养的TEER在第12天达到接近单一培养的水平,而直接共培养的TEER在实验的其余时间(第14天;无花果。2c).在我们基于hCMEC/D3的模型中,共培养3-4天后达到峰值TEER,不超过30±8 Ω x cm214天内(附加文件)2:图S2c),仍远低于生理范围[40]。对NaF的渗透率为2.25±0.36 × 105cm/s直接共培养(附加文件2:图S2d)。与hCMEC/D3单一培养相比,hCMEC/D3- lmc直接共培养也检测到TEER升高,并伴有NaF通透性降低(附加文件)2:图S2d)。然而,最大TEER与LMC细胞单独的TEER相当(37±17 Ω x cm)2;额外的文件2图S3a)。总之,随着时间的推移,LMC共培养增加了BEC屏障的紧密性和稳定性,这反映在较低的NaF渗透率和较高的TEER上。这种效应在高TEER的iBEC模型中最为明显,并且在直接和间接共培养中都观察到,这表明LMC共培养改善了iBEC单层的屏障功能。
脑膜炎奈瑟菌与BECs与LMC共培养的相互作用
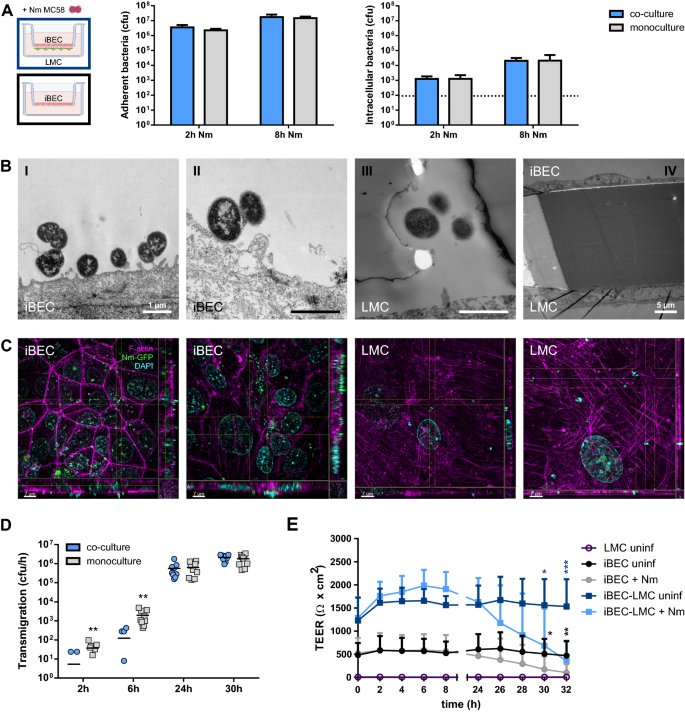
验证mBCSFB共培养模型在感染研究中的应用脑膜炎奈瑟菌,我们首先检查了脑膜炎奈瑟菌BEC层的相互作用。BEC层感染脑膜炎奈瑟菌血清B组MC58与LMCs直接共培养2天(iBEC模型)或3天(hCMEC/D3模型)。为了比较,我们还对iBEC和hCMEC/D3单培养进行了感染实验。用庆大霉素保护试验测定感染后2和8 h细菌粘附和侵袭。脑膜炎奈瑟菌感染2 h后,菌株MC58对iBEC-LMC共培养的ibec有明显粘附(3.58±1.53 × 10)6感染8 h(1.75±0.80 × 10)时,Cfu /单层)和粘附性略有增加7cfu /单层;无花果。3.a).胞内细菌回收率较低(1.26±0.60 × 10)3.Cfu /单层,2 h p.i.),随时间增加(2.06±1.12 × 10)4Cfu /单层,每小时8小时)。单层附着菌和侵袭菌的平均计数与iBEC单层培养相当(图2)。3.a).与iBECs相比,hCMEC/D3- lmc共培养2 h后,在hCMEC/D3层上检测到的粘附细菌数量相似(5.19±2.25 × 10)6(1.39±0.54 × 107cfu/单层)(附加文件2:图S4a)。感染2 h后细胞内细菌计数较低(42±33 cfu/单层),感染8 h后细胞内细菌计数较低(4.43±5.38 × 10)4cfu /单层)。hCMEC/D3- lmc共培养与hCMEC/D3单一培养在粘附性或侵袭性方面无显著差异2:图S4a)。接下来,我们检查了之间的相互作用脑膜炎奈瑟菌以及iBEC-LMC直接共培养模型的ibec。与此同时,iBECs与LMC共培养,用表达菌株MC58突变体的绿色荧光蛋白(GFP)感染24小时,进行f -肌动蛋白染色,并用结构照明显微镜(SIM)分析。我们检测到与iBECs密切相关的细菌,以及先前描述的细胞结构,如附着细菌周围的细胞质突起[29,57) (F我g。3.bI, II)和观察到的脑膜炎球菌群,通常被描述为微菌落(图2)。3.C,左面板)。综上所述,这些结果表明,bc - lmc共培养可作为一种新的、合适的细胞mBCSFB模型,用于感染研究脑膜炎奈瑟菌。
脑膜炎奈瑟菌与iBEC-LMC直接共培养模型的交互。在共培养的第2天,从iBEC侧感染模型(MOI = 10,除非另有说明)。一个感染后,有或没有LMC共培养的iBEC层上的粘附和细胞内cfu/单层计数脑膜炎奈瑟菌MOI为100,由庆大霉素保护试验确定。b感染iBEC-LMC共培养模型的透射电镜脑膜炎奈瑟菌6小时(我)、24小时(2),及30小时(三,四).标尺代表1µm,除非另有标记。c结构照明显微镜显示iBEC或LMC层从iBEC-LMC共培养,染色的f-肌动蛋白(phalloidin-546,洋红色)和DNA (DAPI,蓝色)在感染24小时后表达GFP脑膜炎奈瑟菌压力。图像呈现为Z方向的最大强度投影,包括X和Y方向的最大强度投影(正切面),如十字准星所示。比例尺代表7µm。d脑膜炎奈瑟菌在指定的感染时间点后,在新鲜的基底外侧培养基中孵育1小时后,通过计数基底外侧腔室中的cfu来确定迁移率。e感染和未感染的iBEC单培养和iBEC- lmc共培养在感染后32小时的TEER。数据以三个独立实验的平均值±SD表示,iBEC分化是重复进行的(一个, n = 6)或三个副本(d,e;n = 9)。*p < 0.05, **p < 0.01, ***p < 0.001;学生t检验;直接共栽培(蓝色)与单一栽培(灰色)(d)、感染对照与未感染对照(e)
脑膜炎奈瑟菌穿越mBCSFB模型
接下来,我们研究了的遍历脑膜炎奈瑟菌横跨mBCSFB。感染BEC层后脑膜炎奈瑟菌利用TEM和SIM分析了菌株MC58的iBEC-LMC共培养模型。通过透射电镜,我们能够观察到很少的细菌穿过iBEC-LMC共培养模型,并在24和30 h p.i时与LMC层相互作用。3.bIII, IV). iBEC-LMC模型的SIM分析,表达GFP感染24小时后染色F-actin脑膜炎奈瑟菌MC58菌株,在模型基底外侧的LMC层的顶侧或穿过过程中发现少量脑膜炎球菌(图5)。3.C,右侧面板)。为了量化细菌的迁移,我们在BEC- lmc共培养和BEC单培养模型上进行了细菌迁移实验。2、6、24和30小时后,在新鲜的基底外侧培养基中孵育1小时后,通过计数基底外侧腔室中的cfu来测定细菌的迁移率。虽然ibecc - lmc模型的细菌穿越在2小时后几乎无法检测到,但在6小时后,通过屏障的细菌被检测到的频率更高,数量更多(> 100 cfu/h)。3.d)。在24 h p.i.时,转运率显著增加(0.16-1.76 × 10)6Cfu /h),并在30 h的实验过程中继续增加(0.94-2.92 × 106cfu / h)。在感染的iBEC单培养物中也得到了类似的结果,尽管在感染早期时间点测量到的细菌穿越率更高(0.43-4.84 × 10)3.6h p.i.时cfu/h)(图。3.d)。在hCMEC/D3-LMC模型中,已经检测到较高的细菌迁移率2 h p.i (0.02-1.08 × 106(1.52 ~ 5.28 × 10),增加幅度较小,可达6 h p.i.6Cfu /h),然后保持在大致相同的水平(1.64-8.40 × 106cfu/h, 24小时p.i.)(附加文件2:图S4b)。单独培养的hCMEC/D3s细菌数量与hCMEC/D3-LMC共培养数据相当,但在2 h时略高(0.06-1.8 × 10)6Cfu /h), 24 h时略低(0.24-4.8 × 106cfu/h)(附加文件2:图S4b)。
在之前的研究中,这一直是一个有争议的问题脑膜炎奈瑟菌通过跨细胞通路穿过脑内皮17,29,31]或细胞旁通路[25,28]或两者都有[33]。为了在我们的模型中获得更多关于屏障穿越机制的信息,我们在32小时的时间过程p.i.中测量了TEER,作为屏障完整性和对细胞旁运输的限制的指示。在我们的iBEC-LMC模型中,TEER保持了24小时的高水平。3.e),尽管我们在这段时间内检测到越来越多的细菌迁移(图2)。3.D),提示通过脑膜炎奈瑟菌。此外,我们在感染24小时后使用TEM仍然观察到完整的细胞连接(图2)。3.bII)。然而,感染24小时后,TEER开始下降,与未感染的对照组相比,TEER下降了30小时。3.e)以前也描述过iBEC单一栽培[33]。在本研究中,我们在分析受感染的iBEC单培养物时观察到类似的效果,尽管与iBEC- lmc共培养物相比,TEER总体上较低(图2)。3.e). hCMEC/D3- lmc共培养和hCMEC/D3单培养模型的TEER在感染24小时内也保持稳定,然后下降到显著较低的水平,尽管总TEER比iBEC模型低得多(额外文件)2:图S4c)。这些数据表明,虽然屏障在一段时间内保持完整,但它的时间延长了脑膜炎奈瑟菌感染最终会破坏mBCSFB中BECs屏障的完整性。综上所述,这些结果表明了一种跨细胞途径脑膜炎奈瑟菌尽管在感染后期(感染后> 24小时)屏障完整性丧失,但mBCSFB的穿越也可能使细胞旁穿越成为可能。
长期脑膜炎奈瑟菌感染后屏障恶化
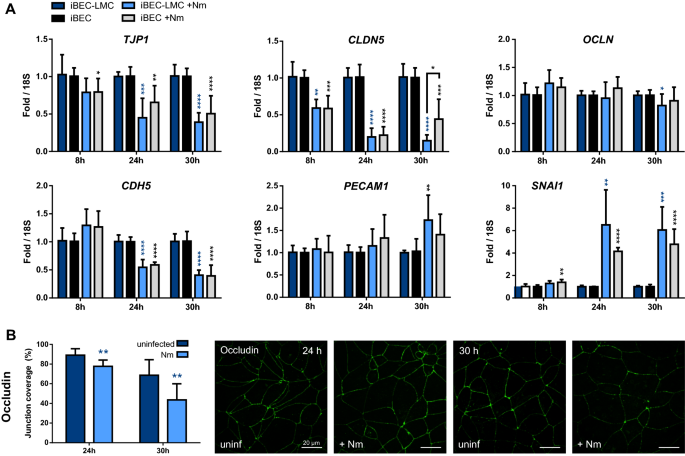
目的:进一步探讨延长后屏障退化的机制脑膜炎奈瑟菌在我们的bc - lmc共培养模型中,我们分析了细胞连接成分的表达。首先,我们从我们的BEC- lmc共培养和BEC单培养模型中检测了受感染BEC中粘附物和紧密连接基因的表达。在iBEC-LMC共培养模型中,内皮粘附连接蛋白VE-Cadherin (CDH5)和紧密连接蛋白ZO-1 (TJP1)及claudin-5 (CLDN5)在感染的iBECs中与未感染的对照相比下调,特别是在24小时和30小时后。4a).效果最强的是CLDN5。CD31 (PECAM1)和闭塞(OCLN)没有改变(图2)。4a).的表达SNAI1编码Snail1, Snail1是紧密连接基因表达的抑制因子[67,68,69,70,71],在指定时间点随感染而显著增加(图2)。4a). iBEC单培养观察到相同的表达谱(图2)。4a)与先前报道的在细胞培养板中培养的iBECs数据一致[33]。与LMC共培养的hCMEC/D3样品的qPCR数据一致且显示减少PECAM1表达除下调外CDH5,TJP1,CLDN5(附加文件2:图5)。有趣的是,OCLN在hCMEC/D3s中随着感染而增加,我们观察到TJP1和CLDN5同时下调SNAI18小时后脑膜炎奈瑟菌感染。这一观察结果与TEER升高等功能变化无关,然而,在iBEC和hCMEC/D3模型的早期感染时间点,偶尔会观察到这种现象(图2)。3.e;额外的文件2:图S4c)。综上所述,这些数据表明了紧接和粘附连接基因的下调脑膜炎奈瑟菌感染。
的影响脑膜炎奈瑟菌感染对单培养和共培养iBECs细胞连接表达的影响。一个内皮粘附连接蛋白CD31 (PECAM1)和ve -钙粘蛋白(CDH5)和紧密连接元件ZO-1 (TJP1),闭塞(OCLN),以及claudin-5 (CLDN5)与lmc直接共培养的iBEC(蓝色条)和iBEC单培养(黑色/灰色条),有(浅色条)或没有(深色条)脑膜炎奈瑟菌用qPCR定量并归一化为18S rRNA。数据以四个独立实验的平均值±SD表示,iBEC分化为重复(n = 6-8)。b使用共聚焦显微镜和JAnaP结分析软件分析iBEC- lmc共培养iBEC单层中occludin的结覆盖率[58]。数据以三个独立实验的平均路口覆盖率±SD表示,每个实验使用三张图像的平均路口覆盖率数据计算(n = 9)。根据这些计算选择具有代表性的图像。* * * p < 0.05, p < 0.01, * * * p < 0.001, * * * * p < 0.0001;学生t检验;感染对照与未感染对照(蓝色/黑色星号直接在条形图上),单株vs共培养(方括号上方的星号)
为了评估Snail1是否在这一机制中发挥作用,我们进行了siRNA敲低SNAI1分析其对hCMEC/D3细胞中细胞连接基因表达的影响脑膜炎奈瑟菌感染(附加文件)2:图S6)。SNAI1敲除导致表达增加CLDN5,CDH5,PECAM1,都是Snail1的目标[72]。然而,我们没有观察到明显的拯救作用脑膜炎奈瑟菌诱导这些基因的下调。总之,这些发现表明,除了Snail1介导的抑制外,其他机制可能是导致细胞连接基因下调的原因脑膜炎奈瑟菌感染。
先前对单一栽培的长生不老BECs的研究表明脑膜炎奈瑟菌调节粘附连接蛋白和极性复合物的定位并影响脑内皮细胞紧密连接的表达[25,28]。评估评估…的影响脑膜炎奈瑟菌关于occludin的定位和表达,我们使用共聚焦显微镜和最近开发的连接分析软件JAnaP分析了iBEC-LMC共培养模型在感染菌株MC58 24和30 h后的BEC层[58]。在这里,我们观察到24小时和30小时每小时结覆盖率降低。4c).综上所述,这些结果表明脑膜炎奈瑟菌尽管在mBCSFB模型中lmc增强了BECs的屏障功能,但在感染后期,lmc会导致BECs的屏障解体。
LMC共培养BECs对脑膜炎奈索菌感染的免疫应答
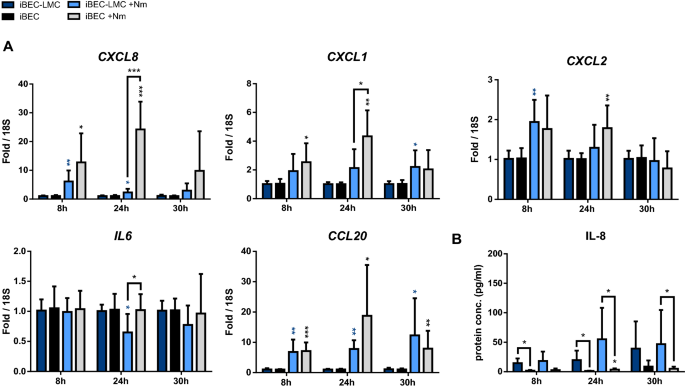
最后,我们在mBCSFB模型中检测了BECs的免疫激活脑膜炎奈瑟菌考虑到BEC激活可能有助于白细胞向脑脊液募集和细菌性脑膜炎的进展[73]。利用qPCR技术,我们研究了中性粒细胞趋化剂和激活剂IL8 (CXCL8), C-X-C基序趋化因子1和2 (处于受控,CXCL2), C-C基序趋化因子20 (CCL20),以及广泛的细胞因子白介素-6 (白细胞介素6).在iBEC- lmc和iBEC单培养中,CXCL8,处于受控,CXCL2,CCL20在感染过程中表达上调,其中CXCL8和处于受控在24 h p.i.的单一栽培模型中。5a).尽管mRNA表达显著增加,但ELISA在细胞培养上清液中几乎检测不到IL-8(图2)。5b). iBECs与LMCs共培养的顶端培养基中蛋白质浓度略高。然而,这种影响可能是由于脑膜瘤衍生的lmc分泌IL-8,这在之前的研究中有描述[34]。这些观察结果,包括iBECs中细胞因子表达和分泌之间的脱节,与先前在细胞培养板中使用iBECs作为单层培养来模拟感染的研究一致脑膜炎奈瑟菌及B组链球菌(33,50]。所有细胞因子和趋化因子的高度显著上调,包括CXCL8,处于受控,CXCL2,CCL20,以及……白细胞介素6在hCMEC/D3与LMC共培养(附加文件)中观察到2:图7a)。这种效应与hMCEC/D3单一培养的数据一致,尽管相对于CXCL8,处于受控,白细胞介素6在某些时间点,表情略低。与iBEC模型相比,在hCMEC/D3模型的细胞培养上清中检测到高蛋白水平的IL-8(附加文件)2:图S7b)。综上所述,这些结果表明,与LMCs共培养的iBEC和hCMEC/D3相比,iBEC和hCMEC/D3中相关的促炎细胞因子上调,并提示BECs对脑膜炎奈瑟菌感染在mBSCFB的免疫激活中起作用,如前所述[33,50,73]。
讨论
细菌性脑膜炎是一种严重的疾病,当病原体如脑膜炎奈瑟氏菌(脑膜炎球菌)穿过脑膜血-脑脊液屏障(mBCSFB)感染脑膜[beplay靠谱1,2]。mBCSFB由特化的脑内皮细胞(BECs)组成,这些细胞表现出屏障表型以维持大脑稳态,并被轻脑膜细胞(lmc)包围[1,8]。由于人类的排他性脑膜炎奈瑟菌,大多数在mBCSFB检测脑膜炎球菌相互作用的研究都使用了原代或永生化BECs,然而,这些BECs在体外缺乏关键的屏障表型[11,40,41]。脑膜炎奈瑟菌利用脑膜瘤衍生的lmc研究了单独与lmc的相互作用[34,35,36,37]。然而,脑膜炎球菌对mBCSFB的渗透尚未在多细胞环境下进行研究,包括体外这种细胞类型。在这里,我们使用iPSC衍生的BECs (iBECs)或hCMEC/D3细胞与脑膜瘤衍生的LMCs共培养,以建立更复杂和生理相关的体外模型进行研究脑膜炎奈瑟菌-mBCSFB交互。
BECs的特征表型包括内皮标记物、紧密连接表达、屏障特性、功能性营养物质和外排转运蛋白,以及对其他中枢神经系统细胞类型的反应[74]。为了在体外模型中对BEC进行基准测试和验证,使用了某些方法,包括TEER测量、渗透性测定和关键标记物(如内皮粘附物和紧密连接)的免疫染色[40]。原代和永生化BECs具有可扩展性,已广泛用于血液-中枢神经系统屏障的建模,但一旦从其原生微环境中移除,通常会失去重要的屏障表型[11]。广泛表征的永生化微血管内皮细胞系hCMEC/D3保留了许多BEC特征,但表现出较低的TEER,并且经常缺乏细胞-细胞连接处紧密连接成分的连续表达[11,41,42,43,75[附加文件2:图S2)。尽管存在这些缺陷,hCMEC/D3s仍是一种强大且广泛使用的体外模型脑膜炎奈瑟菌-BEC相互作用[14,15,16,28]。
干细胞技术的进步已经产生了由iPSCs衍生的脑内皮样细胞模型,这些细胞具有所有相关的BEC表型,包括内皮标记物、紧密连接表达、屏障特性、对其他中枢神经系统细胞类型的反应以及功能性外流转运体[11,44,45,48,49,66]。在最初的协议发表之后,对这些模型进行了大量的研究,揭示了优点和缺点,并建立了替代协议和改进。所描述的限制是上皮基因和蛋白质的表达,除了所描述的内皮表型外,还检测到上皮基因和蛋白质的表达[76]。在这项研究中,我们根据先前发表的协议将iBECs从iPSC系IMR90-4中分化出来[44,46,48]并将它们与lmc在可渗透的transwell插入物上共同培养。我们观察到重要的脑内皮标志物,如CD31、VE-cadherin和claudin-5在iBEC层内清晰表达,但上皮特征也存在,特别是与细胞结构有关,如顶端表面的小突起,细胞高度和细胞核较大,以及细胞间连接的上皮样组织(图5)。2).尽管在使用该模型时必须考虑这些限制,但由于其主要优点(如紧密阻隔特性),它仍然适用于某些应用。最近,iBECs已被用于模拟各种中枢神经系统疾病,包括亨廷顿氏病,MCT8缺乏症(引起Allan-Hurndon-Dudley综合征)和传染病[33,46,50,51,52,53,77,78,79]。
体外血脑屏障模型屏障性能的重要基准是高TEER与溶质的细胞旁通透性呈负相关(尽管非线性)[40],尽管体内数据仅适用于麻醉青蛙和大鼠的脑脊液微血管[80]。这种关系(单相指数衰减)首次在大鼠原发性BECs上得到证实,其中荧光素钠的渗透系数值低于2 × 106高于阈值TEER 130 Ω cm2(81]。iPSC衍生的BECs通常达到1500 Ω x cm以上的TEER值2和NaF渗透率值在10数量级7厘米/秒(33,44,46,47,49,66(图。2c, d)。在这项研究中,我们观察到LMC共培养进一步增加了iBEC屏障的紧密性和稳定性,这反映在较低的NaF渗透率和较高的TEER上。虽然iBECs单独可以表现出高度的细胞旁紧密性,但据报道,与来自神经血管单位的其他细胞(如星形胶质细胞和周细胞)共培养对iBECs屏障特性具有刺激和稳定作用,这表明iBECs对来自其他中枢神经系统细胞类型的提示有反应[11,40,44,45,49,66,82,83,84]。星形胶质细胞和周细胞在原代牛、猪、啮齿动物或灵长类动物的BEC模型中也显示出血脑屏障特性,这些模型显示出与生理相关的细胞外限制水平,而人类原代和永生化BEC系没有达到这一水平。11,40,41,85]。与薄脑膜细胞共培养,这在人类mBCSFB的背景下是重要的,以前没有探索过。我们观察到,与单一培养相比,直接与LMCs在transwell膜上共培养的hCMEC/D3细胞的TEER略高,NaF通透性较低,尽管由于整体TEER较低,这些影响与hCMEC/D3层屏障表型的变化无关。
认识到人体体外系统表现出生理屏障紧密性的优势,最近越来越多的研究使用iPSC衍生的BECs来模拟与GBS、寨卡病毒和最近的SARS-CoV2等CNS病原体的相互作用,特别是研究这些病原体如何影响和穿透血液-CNS屏障[33,46,50,51,52,53,54]。最近,我们验证了iPSC衍生的BECs与人类特异性细菌的感染研究脑膜炎奈瑟菌(33]。由于单培养的体外模型只能较远地代表原生微环境,使用体内模型研究与人类特异性的相互作用脑膜炎奈瑟菌只限于人源化的啮齿动物[86],更复杂的体外模型可能有助于研究这种宿主-病原体相互作用。iBECs和其他中枢神经系统细胞类型的共培养系统现在被广泛用于模拟血-中枢神经系统屏障的功能和功能障碍[40,44,45,49,66,82,83,84但尚未用于中枢神经系统病原体的感染研究。因此,我们开发并使用了ibecc - lmc共培养模型来检测脑膜炎球菌与mBCSFB的相互作用和穿越。
我们观察到,感染后不久,在iBEC-LMC共培养系统中,细菌对ibec有大量粘附,这与我们使用hCMEC/D3s与LMC共培养的结果以及已发表的数据一致[14,17,18,26]。这种紧密的相互作用主要由脑膜炎球菌IV型菌毛(Tfp)介导,对血管定植和最终渗透mBCSFB至关重要[14,15,16,17,18,26,28]。能垒穿越的机制脑膜炎奈瑟菌这个问题已经争论了很长时间。大多数能引起脑膜炎的细菌包括脑膜炎奈瑟菌B组链球菌,链球菌引起的肺炎,大肠杆菌K1,通过细菌侵入细胞后的跨细胞途径或通过细胞连接破坏或细胞损伤时可用的细胞旁途径穿透血液-中枢神经系统屏障,如mBCSFB [1,2]。BECs的细胞侵袭脑膜炎奈瑟菌外周、骨髓来源、脑微血管来源,以及最近iPSC来源的体外BECs,已经观察到,这表明了一个跨细胞途径脑膜炎奈瑟菌mBCSFB的遍历[17,18,26,27,29,30.,31,32,33]。在这项研究中,我们还发现脑膜炎奈瑟菌在我们新开发的与lmc共培养系统中,侵袭iPSC衍生的BECs和hCMEC/D3细胞。虽然一开始相对较低,但在长时间感染期间细菌侵袭显著增加,这在另一种永生化BEC模型中有报道,可能是由于粘附素的屏蔽和多糖胶囊下调后的侵袭[18]。与lmc共培养不受影响脑膜炎奈瑟菌粘附性或浸润性BECs。最后,我们观察到iBEC和iBEC- lmc模型在感染后24小时内脑膜炎球菌迁移增加,而屏障完整性仍然很高。考虑到这些模型表现出生理屏障紧密性,这些观察结果进一步支持跨细胞屏障穿越假说脑膜炎奈瑟菌。
有趣的是,我们观察到较高的细菌迁移率通常与较低的TEER相关。例如,与iBEC模型的数据相比,在感染后最早的测量时间点,基于hCMEC/D3的模型的迁移率已经大大高于hCMEC/D3模型,我们甚至在iBEC单一培养中检测到比iBEC- lmc共培养模型更多的脑膜炎球菌,尽管绝对计数较低。这表明,使用具有生理屏障紧密性的模型对于研究细菌的穿越可能是重要的脑膜炎奈瑟菌可能通过细胞旁通路穿过BEC屏障。先前的研究表明,这种途径确实可以通过破坏细胞连接来实现[15,25,28,33]。在感染的hCMEC/D3s中,检测到粘附体连接蛋白VE-Cadherin对路西法黄的通透性增加和不连续的连接定位,并与脑膜炎球菌BEC屏障穿越相关[j]。15,28]。从机制上讲,连接紊乱是由Tfp介导的细胞间相互作用引发的信号事件引起的脑膜炎奈瑟菌和hCMEC/D3s,导致黏附脑膜炎球菌菌落下的细胞骨架和细胞连接成分的募集[15,28]。用另一种永生化BEC细胞系(HBMEC),观察基质金属蛋白酶MMP-8介导的紧密连接蛋白occludin的裂解和细胞脱离脑膜炎奈瑟菌挑战(25]。在这项研究中,我们观察到在感染24小时后,与LMCs共培养的iBECs中TEER的丧失和occludin连接覆盖的减少。此外,先前在平板上培养的iBEC单培养的数据表明脑膜炎奈瑟菌感染(33]。综上所述,这表明受感染的iBECs中存在occludin的调节,尽管需要进一步的研究来充分阐明这一机制。
除了细胞连接成分的紊乱外,我们还研究了脑膜炎奈瑟菌感染对BECs粘附蛋白和紧密连接蛋白基因表达的影响是屏障恶化的潜在机制,并发现VE-Cadherin、ZO-1,尤其是内皮特异性紧密连接蛋白claudin-5编码基因的表达在感染的iBECs中显著下调,主要在感染24 h后或更晚。同时,蜗牛-1 (SNAI1),一种紧密连接的转录抑制因子[67,68,70,71],之前与B组有联系链球菌,链球菌引起的肺炎,大肠杆菌K1诱导血脑屏障破坏[69,87,88],被上调了。这些结果在iBEC- lmc共培养、iBEC在transwell上单培养和iBEC平板培养中是一致的[33]。此外,脑膜炎奈瑟菌感染对细胞连接基因的表达也有类似的影响SNAI1在hCMEC/D3s中,有无LMC共培养。总之,这些发现表明,除了连接蛋白的重组外,紧密和粘附连接基因也下调脑膜炎奈瑟菌诱导屏障破坏。然而,Snail1介导的转录抑制似乎不是这种效应背后的唯一机制,正如siRNA敲低实验所表明的那样。需要进一步的研究来阐明这一机制。总之,虽然脑膜炎球菌入侵BECs可能有助于早期穿越,但屏障特性的恶化可能在感染后期开辟更容易到达的细胞旁途径。
脑膜炎球菌与mBCSFB的相互作用和蛛网膜下腔的增殖引起强烈的炎症反应,由BECs和LMCs的免疫激活引发,并导致白细胞(最初主要是中性粒细胞)的涌入[1,8]。先前的研究表明,B组链球菌和脑膜炎奈瑟菌引起中性粒细胞化学引诱剂在iPSC衍生BECs中的上调[33,50]。与这些发现一致,我们观察到IL-8 (CXCL8),处于受控,CXCL2和CCL20在有和没有lmc的transwell插入物上培养的iBECs中。这表明iBECs在应对细菌感染时激活了先天免疫反应机制。然而,尽管这些因子的转录上调,但我们的研究以及之前的研究表明,相关蛋白的分泌几乎无法检测到[33,50]。hCMEC/D3s以类似的方式对感染作出反应,尽管所有分析的基因转录本都大幅上调,并且在该模型中检测到高水平的细胞因子分泌。需要进一步的研究来充分阐明BECs对细菌感染的炎症反应,并确定在iBECs中观察到的低丰度分泌细胞因子是否具有生物学相关性。脑膜炎球菌在穿越mBCSFB后相互作用时lmc的激活也可能导致蛛网膜下腔的炎症,以及之后各种细胞因子的分泌脑膜炎奈瑟菌在脑膜瘤衍生的lmc中已证实有感染[34,35,37]。
结论
在这项研究中,我们首次报道了人类iPSC衍生的BECs或hCMEC/D3s与脑膜瘤衍生的LMCs共培养的研究脑膜炎奈瑟菌在生理学相关的背景下mBCSFB的相互作用。正如与其他中枢神经系统细胞类型共培养时所描述的那样,iBECs对来自共培养LMCs的信号做出反应,从而改善屏障的紧密性和稳定性。脑膜炎奈瑟菌与iBEC-LMC共培养模型相互作用并渗透,破坏屏障功能,与先前的数据一致。LMC共培养一般不影响BEC对感染的反应。总的来说,我们的数据表明,显示生理屏障紧密性的模型可以为病原体对血液-中枢神经系统屏障的调节和渗透提供相关的见解,证明了iBECs在模拟与脑膜病原体相互作用方面的有用性脑膜炎奈瑟菌。
数据和材料的可用性
本研究中使用和/或分析的数据集可应通讯作者的合理要求向其提供。
缩写
- CSF:
-
beplay靠谱
- mBCSFB:
-
脑膜血- csf屏障
- 中枢神经系统:
-
中枢神经系统
- BBB:
-
血脑屏障
- BEC:
-
脑内皮细胞
- LMC:
-
Leptomeningeal细胞
- iPSC:
-
诱导多能干细胞
- 位:
-
IPSC-derived BEC
- 透射电镜:
-
透射电子显微镜
- SIM卡:
-
结构照明显微镜
- te:
-
跨内皮电阻
- 氟化钠:
-
荧光素钠
- 纳米:
-
脑膜炎奈瑟氏菌
- 我:
-
感染的多重性
- 菌落:
-
集落形成单位
- 皮。
-
感染后
参考文献
Doran KS,等。细菌性脑膜炎中宿主-病原体的相互作用。神经病理学杂志,2016;31(2):185-209。
Le Guennec L,等。细菌病原体通过血脑屏障的策略。中国生物医学工程学报,2014;22(1):563 - 563。
Jafri RZ等。侵袭性脑膜炎球菌病的全球流行病学。人口健康监测,2013;11(1):17。
Rouphael NG, Stephens DS。脑膜炎奈瑟菌:生物学、微生物学和流行病学。方法:中华医学杂志。2012;39(1):1 - 20。
Stephens DS, Greenwood B, Brandtzaeg P.流行性脑膜炎,脑膜炎球菌血症和脑膜炎奈瑟菌。柳叶刀》。2007;369(9580):2196 - 210。
脑膜炎球菌携带与疾病-种群生物学和进化。疫苗。2009;27(增刊2):B64-70。
张建军,张建军,张建军,等。脑膜炎球菌感染的分类和发病机制。方法:中华医学杂志。2012;39(1):21 - 35。
韦勒·罗,等。脑膜是与啮齿动物和人类中枢神经系统有关的液体、细胞和病原体运动的屏障和促进者。中国生物医学工程学报,2018;36(3):363-85。
coureil M等。大脑之旅:了解细菌病原体如何穿过血脑屏障。微生物学报,2017;15(3):149-59。
王晓明,王晓明。血脑和血脑脊液屏障:功能和功能障碍。beplay靠谱免疫学杂志,2009;31(4):497-511。
Helms HC,等。体外血脑屏障模型:常用脑内皮细胞培养模型的概述及其使用指南。脑血流杂志,2016;36(5):862-90。
Rua R, McGavern DB。脑膜免疫研究进展现代医学杂志,2018;24(6):542-59。
脑膜炎奈瑟菌与人血-脑脊液屏障细胞相互作用的分子机制。beplay靠谱2017。https://doi.org/10.1093/femspd/ftx023。
伯纳德·SC等人。致病性脑膜炎奈瑟菌利用CD147进行血管定植。中华医学杂志,2014;20(7):725 - 731。
coureil M等。脑膜炎球菌劫持β -肾上腺素受体/ β -阻滞素途径穿过脑微血管内皮。细胞。2010;143(7):1149 - 60。
Maissa N,等。脑膜炎奈瑟菌与内皮细胞结合的强度需要由α -肌动蛋白-4组装的高度有序的CD147/ β -肾上腺素受体簇。学报,2017;8:15764。
Sa ECC, Griffiths NJ, Virji M.脑膜炎奈瑟菌(Neisseria meningitidis Opc invasin)与活化玻璃体连接蛋白的硫酸酪氨酸结合,附着并侵入人脑内皮细胞。中华医学杂志,2010;6(5):e1000911。
A,等。纤连蛋白介导脑膜炎奈瑟菌在人脑微血管内皮细胞中的opc依赖性内化。中华微生物学杂志,2002;46(4):933 - 946。
Comanducci M,等。一种新的脑膜炎奈瑟菌候选疫苗NadA。中华医学杂志,2002;16(1):1 - 4。
洪建平,李建平,李建平,等。奈瑟菌黏附素的生物学研究。生物学。2013;2(3):1054 - 109。
Scarselli M等。脑膜炎奈瑟菌NhhA是一种多功能三聚体自转运蛋白粘连蛋白。中华微生物学杂志,2006;31(3):631-44。
特纳DP,等。MspA是一种免疫原性自身转运蛋白,介导脑膜炎奈瑟菌上皮细胞和内皮细胞的粘附。感染与免疫,2006;74(5):2957-64。
彼得斯,等。奈瑟菌与宿主鞘脂代谢产物相互作用的综述。细胞。2021;10(11):3201。
彼得斯,等。IV型脑膜炎奈瑟菌菌毛触发Ca(2+)依赖性溶酶体转运酸性鞘磷脂酶以提高表面神经酰胺水平。中华感染与免疫杂志,2019;87(8):991 - 991。
Schubert-Unkmeir A,等。脑膜炎奈瑟菌诱导脑微血管内皮细胞脱离基质和occludin的裂解:MMP-8的作用。中华医学杂志,2010;6(4):e1000874。
Simonis A,等。酸性鞘磷脂酶和神经酰胺释放的差异激活决定了脑膜炎奈瑟菌对脑内皮细胞的侵袭性。中华医学杂志,2014;10(6):e1004160。
Slanina H,等。脑膜炎奈瑟菌的细胞侵袭需要黏附激酶、Src和接触蛋白之间的功能相互作用。PLoS ONE。2012; 7 (6): e39613。
coureil M等。脑膜炎球菌IV型菌毛招募极性复合物穿过脑内皮。科学。2009;325(5936):83 - 7。
Eugene E,等。微绒毛样结构与强毒荚膜脑膜炎奈瑟菌内化进入血管内皮细胞有关。中国生物医学工程学报,2002;15(6):1231 - 1241。
Lambotin M,等。脑膜炎奈瑟菌入侵内皮细胞需要通过脂寡糖触发的磷酸肌醇-3-激酶/Rac1信号通路进行接触蛋白募集。中国生物医学工程学报,2005;18(6):368 - 368。
Nikulin J,等。人脑微血管内皮细胞内脑膜炎奈瑟菌的细胞内存活和复制。中华微生物学杂志。2006;29(8):553 - 558。
Sokolova O等人。脑膜炎奈瑟菌与人脑微血管内皮细胞的相互作用:MAP-和酪氨酸激酶在侵袭和炎症细胞因子释放中的作用中华微生物学杂志,2004;6(12):1153 - 1156。
马丁斯·戈麦斯SF等。诱导多能干细胞衍生的脑内皮细胞作为细胞模型研究脑膜炎奈瑟菌感染。中华微生物学杂志,2019;10:1181。
Christodoulides M等。脑膜炎奈瑟菌与人脑膜细胞的相互作用诱导一组独特的趋化、促炎和生长因子细胞因子的分泌。感染与免疫。2002;70(8):4035-44。
Fowler MI,等。不同的引起脑膜炎的细菌在与人脑膜细胞相互作用时诱导不同的炎症反应。中华微生物学杂志,2004;6(6):555-67。
Hardy SJ,等。脑膜炎奈瑟菌与人脑膜细胞的相互作用。中华微生物学杂志,2000;36(4):817 - 829。
Humphries HE,等。人脑膜细胞的激活是由脑膜炎奈瑟菌的脂多糖(LPS)和非脂多糖成分调节的,并且不依赖于toll样受体(TLR)4和TLR2信号传导。中华微生物学杂志,2005;7(3):415-30。
Alkuwaity K,等。B组链球菌与人脑膜细胞和星形胶质细胞的体外相互作用。PLoS ONE。2012; 7 (8): e42660。
奥格等人。猪链球菌血清2型与人脑膜细胞和星形胶质细胞的相互作用。生物医学工程学报,2015;8:607。
DeStefano JG,等。体外组织工程血脑屏障模型的基准测试。液体阻碍中枢神经系统。2018; 15(1): 32。
Eigenmann DE,等。hCMEC/D3、hBMEC、TY10、BB19四种永生化人脑毛细血管内皮细胞系的比较研究及培养条件优化,用于体外血脑屏障模型的药物通透性研究。液体阻碍中枢神经系统。2013; 10(1): 33。
Weksler B, Romero IA, Couraud PO。hCMEC/D3细胞系作为人血脑屏障的模型。液体阻碍中枢神经系统。2013; 10(1): 16。
Weksler BB,等。成人脑内皮细胞系血脑屏障特异性的研究。中华医学杂志,2005;19(13):1872 - 1874。
李普曼等。基于干细胞来源的维甲酸增强的多细胞人血脑屏障模型。科学通报,2014;4(4):416。
李普曼等。从人多能干细胞衍生血脑屏障内皮细胞。生物工程学报,2012;30(8):783-91。
李建军,李建军,李建军。诱导多能干细胞来源的脑内皮细胞感染脑膜炎奈瑟菌。中国生物医学工程学报,2010;32(1):391 - 391。
尼尔,EH,等等。从人多能干细胞中产生血脑屏障内皮细胞的一个简化的、完全定义的分化方案。干细胞报告,2019;12(6):1380-8。
Stebbins MJ,等。人多能干细胞衍生的脑微血管内皮细胞的分化与表征。方法。2016;101:93 - 102。
Jamieson JJ等。ipsc源性周细胞对ipsc源性脑微血管内皮细胞2D和3D屏障功能的影响。液体阻碍中枢神经系统。2019; 16(1): 15。
Kim BJ,等。利用诱导多能干细胞衍生的脑内皮细胞建立B组链球菌与血脑屏障相互作用模型。mSphere。2017; 2(6): 1。
Kim BJ,等。无乳链球菌破坏脑内皮细胞p -糖蛋白功能。液体阻碍中枢神经系统。2019; 16(1): 26。
脊柱急诊等。B群链球菌诱导的巨噬细胞增多症有助于细菌侵袭脑内皮细胞。病原体。2022;11(4):474。
Alimonti JB等。寨卡病毒穿过体外人类血脑屏障模型。液体阻碍中枢神经系统。2018; 15(1): 15。
Krasemann S等。在COVID-19中,血脑屏障失调,是SARS-CoV-2进入中枢神经系统的途径。干细胞报告,2022;17(2):307-20。
McGuinness BT等。脑膜炎球菌por基因点突变与地方性疾病增加相关。柳叶刀》。1991;337(8740):514 - 7。
Kim BJ, Schubert-Unkmeir A.脑膜炎奈瑟菌与人脑内皮细胞相互作用的体外模型研究。方法中华医学杂志。2019;1969:135-48。
Mikaty G,等。胞外细菌病原体诱导宿主细胞表面重组以抵抗剪切应力。中华医学杂志,2009;5(2):e1000314。
Gray KM,等。细胞-细胞连接的定量表型评价ZO-1在脑内皮细胞中的表现。生物医学工程学报,2019;47(7):1675-87。
王晓明,王晓明,王晓明。核纤层蛋白CxxM基序对核膜生长的影响。中国生物医学工程学报(英文版);2004;31(2):444 - 444。
Livak KJ, Schmittgen TD。采用实时定量PCR和2(- δ δ C(T))法分析相关基因表达数据。方法。2001;25(4):402 - 8。
HW,等等。用逆转录- qpcr技术鉴定人胃癌基因表达的有效内参基因。中华医学会癌症杂志。2010;10:240。
韩sp,等。SNAI1参与胶质母细胞瘤细胞的增殖和迁移。中国生物医学工程学报,2011;31(3):489 - 496。
van Sorge NM,等。炭疽毒素抑制脑内皮中性粒细胞信号通路,参与脑膜炎的发病机制。PLoS ONE。3 (8): 2008; e2964。
邓文杰,等。生活在中枢神经系统的边缘:健康和疾病中的脑膜细胞多样性。中华神经科学杂志,2011;15:703944。
杨建军,李建军,李建军,等。血脑屏障层粘连蛋白和整合素基因调控的研究进展。液体阻碍中枢神经系统。2022; 19(1): 50。
Hollmann EK等。人诱导多能干细胞向血脑屏障内皮细胞的加速分化。液体阻碍中枢神经系统。2017; 14(1): 9。
Carrozzino F,等。蜗牛的诱导表达选择性地增加细胞旁离子通透性和差异调节紧密连接蛋白。[J] .中国生物医学工程学报,2009;31(4):559 - 561。
Ikenouchi J等。在上皮-间质转化过程中紧密连接的调控:蜗牛直接抑制claudin /occludin基因表达。中国生物医学工程学报(英文版);2003;31(2):559 - 567。
Kim BJ,等。细菌诱导蜗牛1导致血脑屏障破坏。中华临床医学杂志,2015;25(6):773 - 783。
Martinez-Estrada OM,等。转录因子Slug和Snail可抑制上皮细胞中Claudin-1的表达。生物化学学报(英文版);2006;31(2):449 - 457。
Ohkubo T, Ozawa M.转录因子Snail下调紧密连接成分独立于E-cadherin下调。中国生物医学工程学报(英文版);2004;17(5):344 - 344。
王晓华,王晓华,王晓华,等。Snail1基因在肿瘤EMT和耐药调控中的重要作用。[J]中华肿瘤杂志,2014;33(2):1 - 6。
Tunkel AR, Scheld WM。细菌性脑膜炎的发病机制和病理生理。中华临床微生物杂志,1993;6(2):118-36。
Abbott NJ等人。血脑屏障的结构和功能。神经生物学杂志,2010;37(1):13-25。
陈建平,等。claudin-5转导的人脑内皮细胞(hCMEC/D3)与猪脑内皮细胞作为血脑屏障模型进行药物转运研究的面对面比较液体阻碍中枢神经系统。2020; 17(1): 53。
李普曼等。基于人多能干细胞的血脑屏障模型述评。液体阻碍中枢神经系统。2020; 17(1): 64。
Kim BJ, Shusta EV, Doran KS。过去和现在的观点在模拟细菌和血脑屏障相互作用。微生物学报,2019;10:13 . 36。
Lim RG,等。亨廷顿氏病ipsc衍生的脑微血管内皮细胞显示wnt介导的血管生成和血脑屏障缺陷。细胞生物学杂志,2017;19(7):1365-77。
valtine GD等。利用mct8缺陷患者的iPSCs模拟精神运动迟缓表明血脑屏障的重要作用。细胞干细胞,2017;20(6):831-843 [j]。
嗨,JP,等等。跨血脑屏障的跨内皮电阻测量:方法的重要回顾。大。2021;12(6):685。
Gaillard PJ, de Boer AG。血脑屏障通透性状况与药物体外通透系数的关系。医药科学,2000;12(2):95-102。
Appelt-Menzel A,等。利用诱导多能干细胞和多能干细胞建立模拟神经血管单元的人血脑屏障共培养模型。干细胞报告,2017;8(4):894-906。
Canfield SG,等。由人诱导多能干细胞衍生的脑微血管内皮细胞、周细胞、星形胶质细胞和神经元组成的等基因神经血管单元模型。液体阻碍中枢神经系统。2019; 16(1): 25。
Canfield SG,等。由脑内皮细胞、星形胶质细胞和来源于人诱导多能干细胞的神经元组成的等基因血脑屏障模型。中国生物医学工程学报,2017;39(6):874 - 888。
Hatherell K等人。利用单培养、共培养和三培养transwell模型建立三维、全人类血脑屏障体外模型。中华神经科学杂志。2011;19(2):223-9。
Johswich KO,等。鼻咽黏膜内脑膜炎奈瑟菌的体内适应性和持久性。中华医学杂志,2013;9(7):e1003509。
Gratz N,等。肺炎球菌神经氨酸酶激活tgf - β信号。微生物学。2017;163(8):1198 - 207。
杨锐,等。通过脑膜炎大肠杆菌诱导VEGFA和Snail-1介导血脑屏障的破坏。Oncotarget。2016;7(39):63839 - 55。
致谢
我们要感谢Claudia Gehrig-Hoen和Daniela Bunsen对样品制备和TEM技术支持,以及Hannah Franke对iBEC培养和实验的技术支持。M.S.和M.J.感谢德国科学与教育部(BMBF, bundesministium fr Bildung und Forschung, Grant # 13N15986)的资助。原理图由BioRender.com创建。
资金
由Projekt DEAL支持和组织的开放获取资金。LME得到了DFG研究培训项目GRK2157的支持,该项目名为“研究人类病原体微生物感染的3D组织模型”,授予亚利桑那州立大学。MJ由GRK2157基金资助,MD由土耳其共和国国家教育部奖学金出国留学项目资助。BJK得到了亚历山大·冯·洪堡基金会博士后奖学金的支持。BJK目前由阿拉巴马大学的启动资金、阿拉巴马大学的小额资助项目奖、阿拉巴马大学的CARSCA奖和阿拉巴马州乳腺癌研究基金会的试点资助。JEOL JEM-1400Flash电子显微镜由德国研究基金会(DFG)资助-426173797 (INST 93/1003-1 FUGG)。脑膜细胞的研究得到了英国脑膜炎协会的资助。
作者信息
作者及单位
贡献
LME、BJK和ASU对研究的构思和设计做出了贡献。LME, BJK和ASU参与了实验设计并撰写了论文。LME、MJ和MD进行了实验和数据分析。ASU, BJK, MS, CS和MC为数据分析和解释提供了材料和输入。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
beplay體育施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
补充信息
附加文件1:视频S1。iBEC-LMC共培养紧密连接蛋白ZO-1的免疫荧光染色,共培养2天后进行(动画体积视图)。DAPI染色细胞核(蓝色)。
附加文件2:图S1。
iBEC-LMC共培养模型中层粘连蛋白的表达。图S2。hCMEC/D3-LMC共培养模型的表征。图S3。LMC单层膜的屏障特性及iBEC-LMC共培养时间的延长。图S4。脑膜炎奈瑟菌与hCMEC/D3-LMC直接共培养模型的交互作用。图S5。的影响脑膜炎奈瑟菌感染对hCMEC/D3单培养和共培养模型细胞连接表达的影响。图S6。的影响SNAI1可拆卸的上脑膜炎奈瑟菌诱导hCMEC/D3细胞连接表达下调。图S7。的影响脑膜炎奈瑟菌感染对hCMEC/D3单培养和共培养模型中促炎细胞因子表达的影响。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
恩德雷斯,m.m.,荣格布鲁特,m.m.,迪维亚皮西吉尔,m.m.。et al。建立脑膜血- csf屏障多细胞体外模型进行研究脑膜炎奈瑟氏菌感染。流体屏障19, 81(2022)。https://doi.org/10.1186/s12987-022-00379-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12987-022-00379-z
关键字
- 脑内皮细胞
- Leptomeningeal细胞
- 脑膜炎奈瑟氏菌
- 诱导多能干细胞
- 脑膜血- csf屏障
- 细菌性脑膜炎