抑制溶血磷脂酸受体1可通过LPA1/TSP1/CXCR2途径缓解中枢神经系统中PMN的募集,减轻小鼠脑出血后血脑屏障的破坏
中枢神经系统的液体和障碍体积20.、物品编号:33(2023)
摘要
背景
自发性脑出血(ICH)的发病率和损害发生率相对较高。由于脑出血引起的后续脑损伤,血脑屏障(BBB)完整性受到损害,这对预后不良至关重要。多形核白细胞(PMN)强烈调节中枢神经系统(CNS)血脑屏障的破坏。溶血磷脂酸受体1 (LPA1)介导星形胶质细胞血小板反应蛋白1 (TSP1)调控,诱导巨噬细胞炎症蛋白2(MIP2)分泌。MIP2通过CXC趋化因子2型(CXCR2)激活增强PMN募集。本研究的目的是探讨lpa1介导的脑出血后PMN募集抑制和血脑屏障保护是否受TSP1和CXCR2网络的调控。
方法
用胶原酶诱导CD1小鼠脑出血。AM966是一种靶向LPA1拮抗剂,在ICH后1和12小时口服。为了进一步确定可能的lpa1介导的血脑屏障保护机制,我们在脑室内(ICV)给药CXCR2配体MIP2,以及用AM966激活TSP1 CRISPR (ACT)。因此,我们进行了神经行为学、脑含水量(BWC)、埃文斯蓝染色(EBS)、免疫荧光(IF)和免疫印迹(WB)分析。
结果
脑出血后,星形胶质细胞表现为LPA1, 24 h后达到峰值,PMN\表现为CXCR2。am966介导的LPA1抑制缓解了PMN的募集,减少了脑水肿,表现出外渗(如EBS所证明的),保护了血脑屏障的完整性,并增强了脑出血后的神经活动。AM966处理显著降低了ICH后TSP1、CXCR2、Occludin和Claudin-5的表达和PMN的募集,并通过MIP2和TSP1 CRISPR (ACT)恢复了它们的表达。
结论
本研究表明,LAP1抑制可通过TSP1/CXCR2信号传导减少小鼠脑出血后PMN的募集,从而减少血脑屏障的破坏,改善中枢神经系统的神经行为功能。因此,LPA1是脑出血后减少PMN募集和保护血脑屏障完整性的强有力候选药物。
背景
自发性脑出血(ICH)是一种由血液外渗到脑实质引起的中风。它与相对较高的发病率和致残率有关[1]。约有35 ~ 52%的患者在脑出血后30天内死亡,长期预后相对较差[2,3.]。最近的大流行研究表明,脑出血发病率有所增加,现在在年轻人中出现的比例越来越大。然而,很少有有效的治疗方法可以从这种具有挑战性的疾病中恢复过来。4]。ich诱导的继发性脑损伤由神经炎症、血脑屏障(BBB)受损、脑水肿和细胞凋亡引起,是导致患者预后不良的重要因素[5]。血脑屏障是调节脑组织和血液之间物质转移的独特系统,其主要功能是保护中枢神经系统(CNS) [6]。血脑屏障破坏诱导中性粒细胞侵袭,进而加重炎症。同时,神经炎症损害血脑屏障的完整性,从而引起脑水肿[7]。根据一项研究,脑水肿扩大,在脑出血后的第一天最为明显[8]。更多的研究关注于血脑屏障保护以改善ICH后的脑功能[9,10,11]。先前的研究表明,脑脊液和血肿周围区域在脑出血后6小时存在白细胞,白细胞浸润增强脑水肿[beplay靠谱12]。多项研究表明,在多种神经系统疾病中,多形核白细胞(PMN)募集与血脑屏障破坏密切相关[13,14,15,16]。PMN是血脑屏障破坏的主要调节剂,缺乏PMN可恢复血脑屏障的完整性,并最大限度地减少神经炎症期间星形胶质细胞的损失[17]。脑出血后保护血脑屏障的潜在治疗策略是招募PMN。
溶血磷脂酸(LPA)是一种具有生物活性的磷脂,当它在大脑中富集时,通过与其六种受体的相互作用促进多种生物功能[18]。溶血磷脂酸受体1(LPA1)参与许多生物代谢过程,如中枢神经系统内的细胞增殖、存活、凋亡和促炎症[19]。我们之前的研究表明,抑制LPA1可减轻脑出血后的神经炎症,有趣的是,我们还证明抑制LPA1可有效减轻脑水肿和中性粒细胞浸润[12]。然而,目前尚不清楚LPA1抑制是否能保持脑出血后血脑屏障的完整性。Hisaoka-Nakashima和他的团队报道,LPA1激活通过星形胶质细胞中的ERK、MAPK、JNK信号网络刺激血栓反应蛋白-1 (TSP1)的分泌[20.]。TSP1是一种细胞外基质蛋白,它与无数配体(即细胞受体、生长因子、细胞因子和蛋白酶)物理结合,以调节许多生理和病理活动[21,22]。既往研究发现,TSP1诱导小鼠血脑屏障渗漏,从而上调巨噬细胞炎症蛋白2 (MIP-2)等趋化因子的释放[23,24]。此外,CXC趋化因子2 (CXCR2)表达通过释放MIP2促进PMN募集。在脑出血后发现TSP1升高[25],但目前尚不清楚这对PMN招聘有何影响。此外,脑出血后LPA1是否通过控制TSP1表达影响血脑屏障完整性尚不清楚。本研究假设LPA1抑制可通过减少小鼠脑出血后通过LPA1/TSP1/CXCR2信号通路募集PMN来保护血脑屏障完整性。我们研究了假定的LPA1拮抗剂am966介导的脑屏障破坏衰减和脑出血小鼠神经功能的相关恢复,以进一步了解LPA1受体在脑出血介导的脑屏障破坏中的作用。
材料与方法
老鼠
总共从美国Charles River获得141只8周龄雄性CD1小鼠,体重在30 - 40 g之间,在ICH手术前分开饲养≥3天,开放食物和水。这些老鼠被随机分成实验组。实验设计、分组及每组小鼠见附图S1及补充表S1。所有动物实验都得到了洛马林达大学的伦理批准,并遵循了美国国立卫生研究院的指导方针。此外,我们遵循ARRIVE (Animal Research: Reporting of In Vivo Experiments)报告标准。
我建立
如前所述,ICH模型的建立[26]。简单地说,小鼠腹腔注射氯胺酮/噻嗪(100/10 mg/kg),达到深度麻醉后,将它们面朝下放置在立体定向头架中(Kopf Instruments, Tujunga, CA)。在中线右侧1.5 mm,脑脊膜后0.9 mm处钻一个1mm的颅毛刺切口,在硬脑膜下4mm处将27号针刺入右侧基底节区。胶原酶(0.075 U,用生理盐水0.5µL体积稀释,VII-S;Sigma Aldrich, St. Louis, MO)使用微输液泵(Harvard Instruments, Holliston, MA)以0.25µL/min的速率给药。然而,假手术小鼠被给予0.5µL生理盐水,而不是引起ich的胶原酶。给药完成后,针头再维持10分钟,以尽量减少给药溶液外渗。随后,用骨蜡封住毛刺孔,取下针刺,缝合皮肤,促进小鼠恢复。采用加热毯将小鼠体温保持在37±0.5℃。
试验协议
实验1
在ICH后,我们通过WB分析小鼠右半球在时间点6,12,24和72 h以及7天(n = 6)的LPA1, TSP1和CXCR2表达。为了确定LPA1在星形胶质细胞内的亚细胞定位,我们在ICH后24 h采用免疫荧光(IF)染色(n = 2)。与LPA1一起,我们还染色了胶质原纤维酸性蛋白(GFAP);用CXCR2进行中性粒细胞弹性酶(NE)染色。对照组小鼠进行假手术(SS)。
实验2
采用Ly6G/CD11b IF染色评估Lpa1选择性拮抗剂AM966 (Advanced ChemBlocks, USA, 30 mg/kg) [12]诱导lpa1介导的PMN募集抑制。将小鼠随机分为3组(n = 6),即SS、ICH + Vehicle (DMSO, ICH + V)和ICH + AM966 (ICH + A)。
实验3
然后,我们评估了AM966抑制LPA1后血脑屏障的完整性。6只小鼠随机分为SS组、ICH + V(DMSO)组和ICH + A组。其中,AM966和载体分别于ich后1和12 h灌胃。脑含水量(BWC)测定于脑缺血后24 h。此外,在ICH后24 h检测CD31/ZO1的Evans Blue染色(EBS)和IF。
实验4
为了进一步研究涉及LPA1/TSP1/CXCR2信号通路的机制,我们使用了MIP2和TSP1 CRISPR激活(ACT)。我们注射了2µl27]的相应crispr (Santa Cruz Biotechnology, USA)在ICH前48 h通过ICV给药注入小鼠。MIP2 (Sigma-Aldrich, USA) 0.01µg [28,29]在ICH后1 h通过ICV给药。小鼠随机分为:SS、ICH + V、ICH + A、ICH + A + PBS、ICH + A + MIP2、ICH + A + CRISPR对照、ICH + A + TSP1 CRISPR。在ICH后24小时进行WB分析。
运动活动评估
改良的Garcia、前肢放置(FP)和转弯检查是盲法进行的,如早期出版物所报道的[30.]。简而言之,改良加西亚测试结合了7种不同的评估,包括自发性、触须接触、侧触、肢体对称、前肢行走、侧向转弯和攀爬活动。我们使用FP测试来量化20次刺激中的左前爪位置。动物被放置在30°竞技场的顶点,并在10次试验中记录左转弯次数。
公约的评估
生物武器含量的测量方法如先前刊物所述[31]。简而言之,在小鼠牺牲后,立即提取脑样本,然后解剖到左/右基底节区、左/右皮层和小脑。使用分析天平(Denver Instrument, USA)称重所有脑解剖部分,以获得相应的湿重(WW)。样品在100℃的烤箱中烘烤24 h后测量干重。生物wc的计算公式为:生物wc (%) = [(WW−DW)/WW] × 100%。
EBS外渗
EBS外渗按先前报道进行[32]。为了制备4%的EBS染料,将EBS粉末(Sigma-Aldrich, USA)重新悬浮在生理盐水中。然后,小鼠腹腔注射(4 mL/kg),孵育3小时。随后,将小鼠置于深度麻醉下,心脏灌注50 mL冰冷的磷酸盐缓冲盐水(PBS),并切除大脑并将其分成左右半球,然后将其保存在- 80°C的冰箱中以待进一步分析。每个脑标本加入1100µL PBS,匀浆,超声,离心(4°C, 14000 rcf, 30 min),得到上清。第二次离心(4°C, 14000 rcf, 30 min)前,加入三氯乙酸(TCA)生成上清。用分光光度计(Thermo Fisher, USA)在610 nm处测定EBS浓度,然后用标准曲线定量。
免疫印迹
western Blot (WB)方案已在前面介绍[33]。简而言之,小鼠在灌注冰冷的PBS之前被麻醉。大脑被切除,接着是两个半球的分离。在4°C下14000 g离心30分钟前,右半球在RIPA裂解缓冲液中均质(Santa Cruz Biotechnology, USA)。从上清中分离的蛋白与上样缓冲液结合,在SDS-PAGE上电泳,转移到硝化纤维素膜上,在阻断缓冲液中阻断2小时,然后在4°C下暴露于补充表中列出的一抗过夜(on)S2。匹配的二抗在室温下孵育1.5 h,然后使用增强型化学发光(ECL) Plus试剂盒(Amersham Biosciences, USA)和成像系统(Bio-Rad, Versa Doc, model 4000)进行蛋白可视化。蛋白定量采用Image J (NIH, USA)。
如果评估
如先前刊物所述,影响因子分析是在[34]。麻醉小鼠用冰冷的PBS灌注,然后切除大脑,10%福尔马林固定,30%福尔马林脱水24小时,用CM3050S低温恒温器(Leica Biosystems,德国)切片至10 μm。接下来将制备好的切片暴露于补充表中总结的一抗中S2在4℃下。接下来,切片在PBS中洗涤,然后在RT下暴露于二抗2小时,随后PBS冲洗和DAPI染色。染色可视化采用荧光显微镜(徕卡显微系统,德国)。
统计分析
使用Graph Pad Prism (San Diego, USA)进行所有统计数据分析。数据以mean±SD表示。多重比较采用单因素方差分析和双向重复测量方差分析,采用Tukey事后检验,p < 0.05为显著性阈值。
结果
小鼠死亡率和淘汰
ICH小鼠的总死亡率为4.4%(5/113),假手术小鼠的总死亡率为0%(0/28)。当所有的实验小鼠进行比较时,死亡率没有明显的变化。所有模型都没有被淘汰。
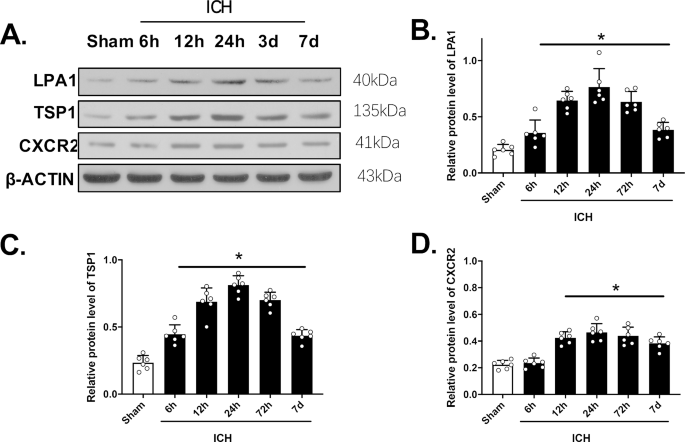
颞叶LPA1、TSP1和CXCR2的表达
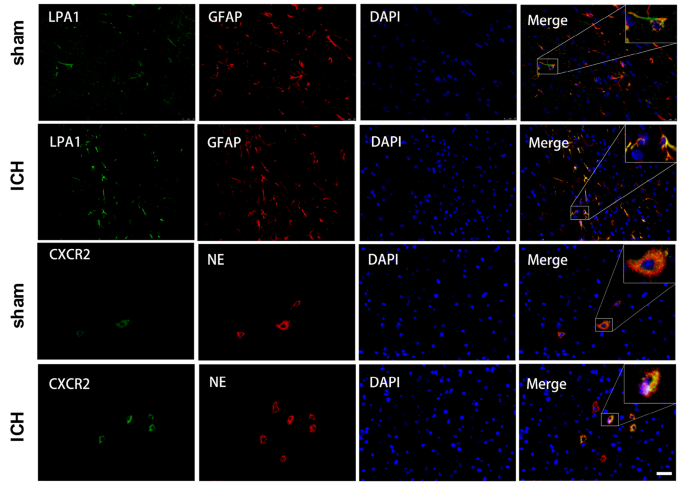
在脑出血后6、12、24和72 h以及7 d,通过WB分析评估右半球LPA1、TSP1和CXCR2的表达。根据我们的结果,这三种蛋白的表达均增强,并在ICH后24小时达到峰值,相对于假手术小鼠(p < 0.05,图5)。1模拟)。通过双IF染色,我们发现LPA1与胶质纤维酸性蛋白(GFAP)在星形胶质细胞中共定位,CXCR2与中性粒细胞弹性酶(NE)在脑出血后24小时的PMN和假小鼠中共定位(图2)。2).
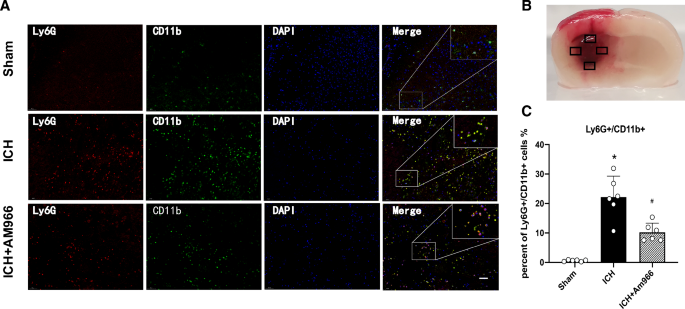
AM966处理减少了PMN的募集
使用基于LY6G/ cd11b的IF染色检测红细胞周围区域的PMN募集(图6)。3.A)。根据我们的结果,与ICH后24小时的车辆暴露相比,AM966暴露强烈地减少了PMN的招募(p < 0.05,图2)。3.B)。
AM966抑制LPA1可减少脑出血后血脑屏障的破坏
通过CD31/ZO-1的EBS和IF染色评估血脑屏障的完整性。与灌胃小鼠相比,脑出血后24小时,血肿周围的EBS外渗明显增强(p < 0.05),给药AM966后,EBS外渗明显减弱(p < 0.05)。4A, B)。在ICH后24小时,血肿周围的CD31和ZO-1重叠强烈减少(p < 0.05),并在给药AM966后升高(p < 0.05,图2)。4C, D)。
Evans蓝染色的代表性图像(一);埃文斯蓝色外渗分析(B);血肿周围区域CD31(红色)和ZO-1(绿色)免疫荧光染色的代表性图像(C)血周区CD31/ ZO-1阳性细胞的定量分析(D)ich后24小时。AM966对脑含水量的影响(E);修正加西亚分数(F);肢体安置评分(G)和转角得分(H);单因素方差分析,Tukey检验,均数±标准差(误差条),(B;D;F-H)和双向重复测量方差分析,Tukey检验,均值±SD(误差条)(E),每组n = 6。*p < 0.05与sham组比较;与ICH + Vehicle组比较,p < 0.05。Ipsi-BG同侧基底节,Ipsi-CX同侧皮质,control - bg对侧基底节,con - cx对侧皮质,小脑
AM966诱导的LPA1抑制减轻了脑出血后的脑水肿,增强了神经功能
在ICH后24和72小时检查生物多样性。与对照小鼠相比,右侧基底节区和皮质BWC分别在24 h和72 h显著增强(p < 0.05),而在给药AM966后明显减弱(p < 0.05,图2)。4E). AM966在ICH后24和72小时恢复神经行为功能(p < 0.05,图2)。4F-H)。
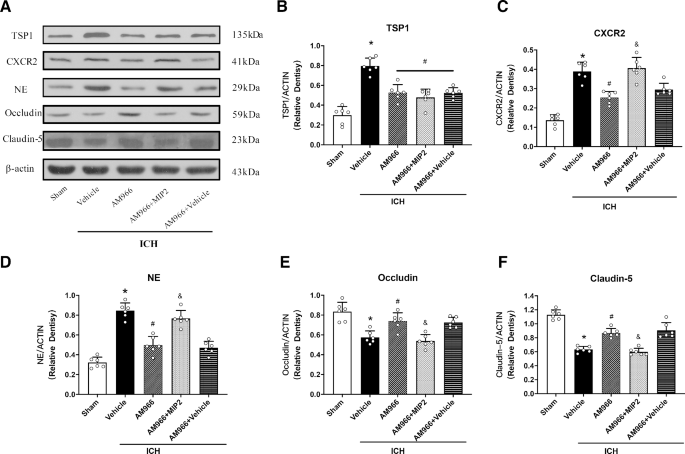
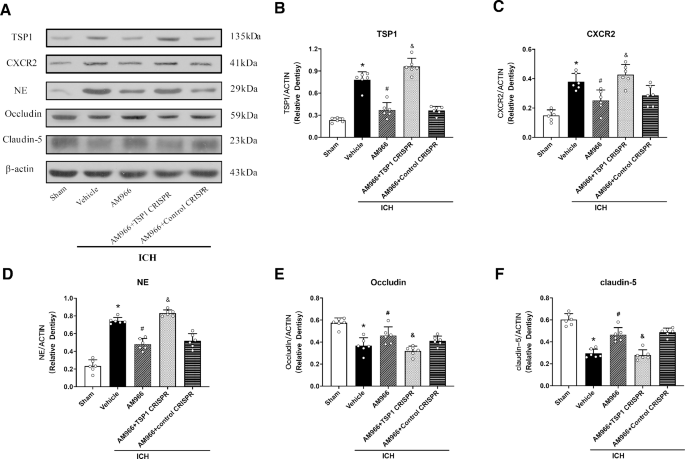
MIP 2逆转了am966介导的血脑屏障完整性保护
数字5在给药AM966后,TSP1、CXC2R、Occludin和Claudin-5的表达以及PMN的募集明显减少(p < 0.05),而在给药CXC2R配体MIP2后,这一过程被逆转,在ICH后24 h, CXCR2的表达上调,PMN募集增强,Occludin和Claudin-5的表达减少(p < 0.05,图5)。5f)。
TSP1激活逆转了am966介导的血脑屏障完整性保护
我们使用TSP1 CRISPR激活质粒(TSP1 CRISPR ACT)刺激TSP1的表达来研究其潜在的机制。数字6结果表明,在AM966治疗后,TSP1、CXC2R、Occludin和Claudin-5的表达以及PMN的募集明显减少(p < 0.05)。此外,TSP1 CRISPR (ACT)上调TSP1表达,持续增强CXCR2表达,增强PMN募集,同时降低Occludin和Claudin-5表达(p < 0.05,图5)。6f)。
讨论
早期的一项研究表明,抑制LPA1可减轻脑出血啮齿动物的神经炎症和脑水肿。本研究探讨了LPA1抑制是否能减轻小鼠脑出血后血脑屏障的破坏,并阐明了这一现象的机制。根据我们的分析,am966诱导的LPA1抑制强烈减少脑水肿和PMN募集,从而增强脑出血后血肿周围区域血脑屏障的完整性。此外,我们研究了AM966介导血脑屏障保护的机制,发现AM966暴露强烈减少了TSP1的释放,并使下游CXCR2、NE、Occludin和Claudin-5的表达失活。相反,CXCR2配体逆转了am966诱导的效应。同样,通过TSP1 CRISPR (ACT)激活TSP1也会产生相同的影响。这些数据表明,LPA1抑制通过下调ICH后通过TSP1 /CXCR2网络募集的PMN来减弱血脑屏障破坏。
LPA受体在中枢神经系统中普遍存在。其中,LPA1对LPA网络的贡献很大。新出现的报道表明,LPA通过LPA1受体激活诱导皮层星形胶质细胞中TSP1的合成[20.]。TSP1和MIP2在PMN募集中上调[35], MIP2招募PMN,并激活CXCR2受体。同样,我们还发现出血半球的LPA1含量在ICH后24 h达到峰值。此外,TSP1和CXCR2均随着LPA1的上调而升高。此外,我们的双IF染色显示LPA1与星形胶质细胞共定位,证实了我们早期的发现。同时,我们的研究结果表明,CXCR2与PMN共定位,这一现象在脑出血后明显增强。还有其他关于脑出血通过继发性脑损伤导致血脑屏障中断的报道[36],而PMN在这一过程中至关重要[37]。在我们之前的研究中,LPA1抑制被用来减少神经炎症和中性粒细胞侵袭,这种方法在使用LPA1选择性拮抗剂AM966的脑出血后显著改善脑水肿和小鼠预后。在此,我们证明AM966强烈下调ICH后PMN的募集和BWC的减少。同样,通过CD31/ZO-1 IF染色和EBS外渗分析,我们发现给药AM966后血脑屏障破坏减轻。我们推测AM966可能会减少PMN的招募,最终改善血脑屏障的完整性。
我们还研究了脑出血后lpa1介导的血脑屏障完整性增强背后的潜在机制。基于新出现的证据,LPA通过激活星形胶质细胞中的LPA1来促进TSP1的释放[20.]。TSP1是特定趋化因子,即JE和MIP-2的调节因子,它们可以通过上调CXCR2受体的表达来增加PMN的募集[23,24,38]。在此,我们证明AM966暴露显著降低了ICH后TSP1和CXCR2的表达以及PMN的募集,同时上调Occludin和Claudin-5的表达。MIP2是一种CXCR2配体,给药显著增强脑组织CXCR2含量和PMN募集,同时逆转AM966的潜在益处。为了证实该网络在血脑屏障保护中的重要性,我们在给药AM966之前使用TSP1 CRISPR (ACT)激活TSP1,并且在给药TSP1 CRISPR (ACT)后,AM966介导的积极作用被逆转。这些证据表明,通过LPA1/TSP1/CXCR2网络抑制LPA1可以保护血脑屏障的完整性。
本研究有一定的局限性。首先,我们只研究了LAP1抑制后PMN招募介导的血脑屏障破坏。脑出血后的血脑屏障破坏病理生理相当复杂,已知LPA1可激活Rho激酶[39,40],这也与血脑屏障紊乱有关[41]。因此,我们不能排除我们实验中看到的血脑屏障保护不是由活化的Rho激酶引起的。其次,其他科学家和我们团队之前的研究表明,中枢神经系统中普遍存在LPA1含量[42,43], LPA1可能是细胞死亡的中介,这需要在未来的研究中进一步探索。第三,我们在实验中每组使用6只小鼠,可能会影响结果的力度,但仍然具有统计学意义。为了提高可靠性,我们将增加进一步研究的动物数量。最后,我们采用EBS外渗来评估血脑屏障的完整性。EBS外渗一般只显示大分子量物质(MWSs) [44]。因此,我们没有评估ICH后小MWSs跨血脑屏障转移的可能性。
结论
根据我们的分析,am966介导的LPA1抑制通过LPA1/TSP1/CXCR2网络显著减少PMN的募集,从而增强血脑屏障完整性,减轻脑水肿。鉴于这些证据,LPA1靶向治疗可能是减少脑出血患者PMN招募和保护血脑屏障的有效治疗方法。
数据可用性
本研究中使用和/或分析的数据集可根据要求从通讯作者处获得。
缩写
- 我:
-
脑内出血
- BBB:
-
血脑屏障
- 中枢神经系统:
-
中枢神经系统
- 中性粒细胞:
-
多形核白细胞
- 摘要:
-
Lysophosphatidic酸
- LPA1:
-
LPA受体1
- 常会:
-
血小板反应蛋白- 1
- CXCR2:
-
CXC趋化因子2型
参考文献
Murthy, s.b.等人。自发性脑出血后抗血小板治疗及功能结局。中风,2019。50(11): p. 3057-3063。
亨普希尔,j.c.,第3等。自发性脑出血的处理指南:美国心脏协会/美国中风协会医疗保健专业人员指南。中风,2015。46(7): p. 2032-60。
吴s,等。中国脑卒中:流行病学、预防和管理方面的进展和挑战。柳叶刀神经杂志,2019。18(4): p. 394-405。
Sondag, L.等。幕上脑出血的神经外科干预。Ann Neurol, 2020年。88(2): p. 239-250。
顾磊,等。激活RKIP结合的ASC通过Caspase-1/GSDMD信号通路减轻小鼠脑出血后神经元焦亡和脑损伤。Transl Stroke Res, 2022。13(6): p. 1037-1054。
孙强,等。脑出血中的神经血管单位和神经胶质网络:从机制到翻译。Transl Stroke Res, 2021。12(3): 447-460页。
Kalyan, M.等人。内源性脂多糖在神经系统疾病中的作用。细胞,2022。11(24)。
李,Z,等。脑出血后,脑转化的自然杀伤细胞会加重脑水肿。中华检验医学杂志,2020。217(12)。
徐磊,等。成纤维细胞通过TIMP2修复血脑屏障损伤和出血性脑损伤。Cell Rep, 2022。41(8): p. 111709。
陈,S,等。针对氧化应激和炎症反应的脑出血血脑屏障保护。抗氧化氧化还原信号,2022。37(1-3): p. 115-134。
Gautam, J., J. h . Miner和Y. Yao,内皮层粘连蛋白α5的缺失加重出血性脑损伤。Transl Stroke Res, 2019。10(6): p. 705-718。
高磊,等。抑制溶血磷脂酸受体1通过PGE2/EP2/NOX2信号通路减轻神经炎症,改善小鼠脑出血的预后。《大脑行为免疫》,2021。91: 615-626页。
温克勒,A.等人。视神经脊髓炎的血脑屏障重新封闭独立于星形胶质细胞再生。J临床投资,2021。131(5)。
孙强,等。核糖体蛋白sa阳性中性粒细胞引起更强的吞噬作用和中性粒细胞胞外陷阱的形成,抑制促炎细胞因子的分泌,对抗猪链球菌血清2型感染。《前沿免疫》,2020。11: p. 585399。
邱彦明,等。急性缺血性卒中后血脑屏障破坏中的免疫细胞:免疫治疗的靶点?Front Immunol, 2021。12: p. 678744。
潘,C., C.佩洛和K.海尼嫩,聚焦超声和微泡介导的血脑屏障治疗后中性粒细胞募集和白细胞反应。开展,2021年。11(4): p. 1655-1671。
鲍当权,等。高密度脂蛋白在体外限制中性粒细胞对血脑屏障的损伤。脑血流杂志,2013。33(4): 575-82页。
Meduri, B.等。溶血磷脂酸(LPA)受体调节剂:结构特点及最新进展。欧洲医学化学杂志,2021。222: p. 113574。
刘思,等。溶血磷脂酸和鞘氨醇1-磷酸对脂质gpcr的差异激活机制。Nat Commun, 2022。13(1):第731页。
Hisaoka-Nakashima, K.等。溶血磷脂酸诱导原代培养大鼠皮质星形胶质细胞产生血栓反应蛋白1。[J]中国生物医学工程学报,2016。(4): p. 849-864。
古铁雷斯,L.S.和J.古铁雷斯,代谢性疾病中的血栓反应蛋白1。前沿内分泌杂志(洛桑),2021。[12] p. 638536。
Lu, Z.和J. Kipnis,血栓反应蛋白1 -星形胶质细胞衍生的关键神经源性因子。[j], 2010。24(6): p. 1925-34。
马丁-曼索,G.等。内源性血栓反应蛋白-1调节白细胞募集和激活,加速全身念珠菌病的死亡。PLoS One, 2012。7(11): p. e48775。
李,a.h.,等。rho激酶抑制剂可预防新生大鼠博莱霉素诱导的损伤,不影响肺部炎症。[J] .中华呼吸杂志,2014。50(1):第61-73页。
周宏杰,等。实验性脑出血后大鼠脑内血栓反应蛋白-1和- 2的变化。实验室调查。神经外科杂志,2010。113(4):第820-5页。
利德尔,l.j.等人。转化性脑出血研究:目前的神经保护研究是否达到了实验设计和报告的标准?transstroke Res, 2020。11(6): p. 1203-1213。
他、W.等人。小鼠脑出血后,激活frizzled7可通过Dvl/β-catenin/WISP1信号通路减弱血脑屏障破坏。流体屏障CNS, 2021。18(1):第44页。
Bajrami, B.等。急性炎症期间,G-CSF通过负性调节CXCR2信号传导维持中性粒细胞动员的控制。中华医学杂志,2016。2013 (10): p. 1999-2018。
Lepsenyi, M.等。CXCL2-CXCR2轴介导αV整合素依赖性结肠癌细胞腹膜转移。临床实验转移,2021。38(4): p. 401-410。
吕琦等人。TREM(髓细胞上表达的触发受体)-1抑制通过PKC(蛋白激酶C) δ/CARD9 (caspase募集结构域家族成员9)信号通路减轻小鼠脑出血后的神经炎症。中风,2021。52(6): p. 2162-2173。
龚磊,等。骨桥蛋白通过JAK2/STAT1通路减轻脑出血后高血糖大鼠的炎症。神经药理学,2018年。138:第160-169页。
Goldim,国会议员,A. Della Giustina和F. Petronilho,用埃文斯蓝染料测定啮齿动物血脑屏障完整性当前免疫方案,2019。126(1): p. 83。
刘彦,等。抑制前列腺素E2受体EP3通过调节p38MAPK/FOXO3/Mul1/Mfn2通路部分减轻大鼠蛛网膜下腔出血后氧化应激和神经元凋亡氧化医学细胞,2022。2022: p. 7727616。
奥德尔,I.D.和D.库克,免疫荧光技术。J Invest Dermatol, 2013。133(1): p. 4。
adib - conquest, M.等。囊性纤维化中的中性粒细胞表现出独特的基因表达模式。Mol Med, 2008。14(1-2):第36-44页。
梅,S,等。脑出血后脑及血液中白细胞的变化。Front Immunol, 2021。[12] p. 617163。
庞旸,等。IGF-1在发育中的大鼠脑中可以防止或增加脂多糖引起的损伤。儿科研究,2010。67(6): 579-84页。
Tatematsu, Y.,等;血小板反应蛋白-1是角膜神经发育和修复所必需的。中华医学杂志,2018。19(10)。
顾忠,等。针对LPA1信号通路的纤维化治疗:专利审查(2010年至今)。专家意见,2022年。32(10): p. 1097-1122。
García-Morales, V.等;膜源性磷脂控制突触神经传递和可塑性。PLoS Biol, 2015。13(5): p. e1002153。
斯卡利斯,a.a.,等。血脑和肠血管屏障:从克劳丁的角度看。组织屏障,2021年。9(3): p. 1926190。
López-Serrano, C.等;溶血磷脂酸受体2型激活参与小鼠脊髓损伤后的继发性损伤。《大脑行为免疫》,2019。76:第258-267页。
Lummis, n.c.等。LPA(1/3)过激活通过室管膜丧失和纤毛功能障碍诱导新生儿出血性脑积水科学广告,2019。5(10): p. eaax2011。
姚,L,等。埃文斯蓝染料在生物医学上的应用反差媒体Mol成像,2018。2018: p. 7628037。
致谢
不适用。
资金
本研究由国家卫生研究院NS081740和ns082184资助John H. Zhang,海南省自然科学基金项目(No.822MS205),海南省卫生和计划生育产业科研项目(No.21A200327)资助高凌博士,海南省自然科学基金项目(No.821QN1005)资助李鹏博士。海南省临床医学研究中心(No.LCYX202107)资助夏颖博士和海南省临床医学中心。
作者信息
作者及单位
贡献
LG和JHZ参与了实验设计。LG, LP, HT, HS, YL, JX进行实验,分析数据,并撰写论文。PS, YJL和JPT负责稿件的修改。YX、JPT参与了实验设计、数据分析与解读、稿件编写。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
所有动物实验均经洛马林达大学机构动物护理和使用委员会批准。该研究遵循了《实验动物护理和使用健康指南》(国家研究委员会),并遵守了报告体内实验的ARRIVE指南。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
beplay體育施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
高丽丽,彭丽丽,Sherchan, P。et al。抑制溶血磷脂酸受体1可通过LPA1/TSP1/CXCR2途径缓解中枢神经系统中PMN的募集,减轻小鼠脑出血后血脑屏障的破坏。流体屏障20., 33(2023)。https://doi.org/10.1186/s12987-023-00434-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12987-023-00434-3
关键字
- 溶血磷脂酸受体
- 颅内出血
- AM966
- 血脑屏障
- 多形核白细胞