摘要
背景
了解大脑中的分子运输对于护理和预防神经系统疾病和损伤至关重要。一个关键问题是,输运是主要通过扩散发生,还是也通过对流或弥散发生。长期以来,动态对比增强(DCE-MRI)实验已经报道了脑内溶质传输似乎比单独扩散更快,但这种传输速率尚未被量化到可以与已知示踪剂扩散速率进行比较的物理相关值。
方法
在这项工作中,使用特定受试者的有限元模型分析DCE-MRI实验数据,以量化整个小鼠大脑不同解剖区域的运输。区域有效扩散系数(\ (D_ {eff} \))是一个结合所有输运机制的输运参数,它最能代表实验数据,并与表观扩散率(\ (D_{应用}\)),即已知的脑组织扩散速率,从而得出每个区域的主要运输机制的结论。
结果
在大动脉血管周围区域,\ (D_ {eff} \)加多啶醇(550 Da)的含量是\ (D_{应用}\).在脑组织中,构成间质空间和小血管的血管周围空间,\ (D_ {eff} \)是10-25倍吗\ (D_{应用}\).
结论
分析得出的结论是,对流存在于整个大脑中。对流在主要表面和分支动脉的血管周围空间中占主导地位(体育> 1000),小血管间质间隙和血管周围间隙的大分子(> 1 kDa)显著(DCE-MRI未解决)。重要的是,这项工作支持沿穿透血管的血管周围对流。
背景
分子运输是脑生理功能的重要组成部分,有助于神经传递、离子稳态、营养输送和废物清除[1].间质分子转运的变化与几种病理状态有关,包括间质肽和蛋白质清除的损害可能是神经退行性疾病中衰老或受伤的大脑易受蛋白质聚集发育影响的基础[2,3.,4].
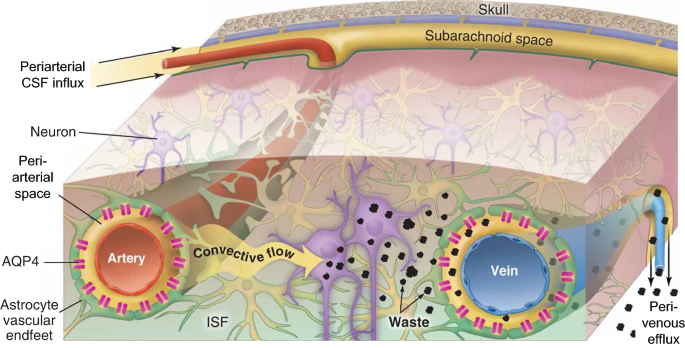
而溶质在脑实质内的运输通常归因于扩散[5], Rennels等。[6]和Cserr等人。[7[报道,注射到脑间质和脑脊液室的示踪剂优先沿着脑血管周围的血管周间隙(pvs)移动,观察到的示踪剂移动太快,无法单独用扩散来解释。beplay靠谱这些PVSs是由内部的血管壁和外部的血管周围星形胶质终足所包围的环形空间。示踪剂的分布模式表明,PVSs在脑间质和脑周围的脑脊液(CSF)中是连续的。beplay靠谱
近年来,随着“类淋巴”系统的描述,这个话题越来越受关注[3.,8,9,10].淋巴系统是一个全脑范围的分子运输系统(图2)。1其中:(1)蛛网膜下腔脑脊液沿穿通动脉周围的PVS进入大脑(与血流方向相同);(2)液体和溶质通过星形胶质终足之间的间隙交换进入间隙;(3)间质液体和溶质沿大口径引流静脉周围的PVS向窦相关脑脊液室排出。脑膜淋巴管的后续表征[11,12]与硬脑膜窦相关,为清除这些间质溶质从颅脑沿淋巴引流提供了最后的潜在步骤。在类淋巴模型中,分布在脑分支血管周围的PVSs为脑表面和脑深部区域之间的液体有效交换提供了低阻力通道,支持溶质输送和废物清除。
脑内血管周围淋巴运输。脑淋巴系统中分子运输机制的示意图。血管周围空间(PVS)围绕着脑血管,由内部的血管壁和外部的星形胶质细胞(绿色)的“终足”所包围。我们提出脑脊液从蛛网膜下腔沿贯穿动脉周围beplay靠谱的动脉周围腔向内进入大脑深处。液体通过星形胶质末梢间的间隙进入间质。间隙溶质(“废物”)通过间隙对流向静脉周围间隙和颅外流出途径清除。星形胶质水通道蛋白-4 (AQP4)水通道促进了血管周围脑脊液内流和间质溶质外排。转载自[13]术语从“旁动脉”更新为“动脉周围”
脑内是否存在血管周围对流和间质对流一直存在争议。14,15,16,17,18,19,20.,21,22].直接测量动脉周围流量为1.2 mm/min [18,19]并引起动脉搏动[9,18,23],这表明PVS内的蠕动流动是由动脉(内)壁对由鞘膜轻脑膜或星形胶质终足组成的刚性外“壁”的脉动产生的。然而,迄今为止,动脉脉冲驱动的动脉周围血流的数学和计算模型并不能复制实验观察到的血流[20.,24,25,26,27],得出一个生理上合理但尚未确定的静态压力梯度是产生实验观察到的流动所必需的[26,27].据预测,与扩散相比,弥散也能适度增强动脉周围运输[20.,28].分散是由浓度梯度和流体流动耦合引起的输运效应[29].动脉周围弥散是由动脉脉动产生的流量波动引起的,相对于单独的扩散或流体的净流量,动脉脉动有助于混合和加速运输。
动脉周围血流的测量只沿着大脑表面的大脑中动脉(MCA)的一小段进行[18,19].观察到的流动特性表明了明渠中的流动[18,23],与多孔介质填充的空间相比,其水力阻力更低。然而,实验中追踪到的直径为1 μm的微球没有进入穿透动脉周围的PVSs [19,23].动脉周围流动可能只发生在表面动脉周围[19]或穿透性血管周围的动脉周围空间可能“有些多孔”,排除了相对较大的微球,同时允许大型可溶性示踪剂的运输[8,19,23].
在间隙空间中,输运模型估计的间隙流表面速度范围从无流动到0.05 mm/min [30.,31,32].0.01 mm/min的间质流动足以影响大小大于1kda的大分子的运输速率,包括与神经退行性疾病有关的肽和蛋白质(β淀粉样蛋白、tau蛋白、突触核蛋白)[30.,32].间质流动模型之间的差异源于对脑组织的水力导电性(流体通过多孔间质空间的难易程度)和动脉周围和静脉周围空间之间的压力梯度的不同假设,这些都是未知的。由于这些不确定性围绕着血管周围和间质流动的存在、大小和范围,对流是否是脑组织内分子运输的重要贡献者尚不清楚。
动态对比增强磁共振成像(DCE-MRI)已经成为研究健康和患病啮齿动物和人类大脑内分子运输的金标准,最近的一篇综述总结了自2013年第一次实验以来的15项此类研究[33,34].DCE-MRI提供了全脑范围的宏观运输视图,补充了双光子显微镜提供的单个血管周围血流的微观视图[8,18].利用DCE-MRI的研究表明,注入小鼠脑蛛网膜下腔脑脊液的造影剂沿着靠近大脑表面的大动脉的优先路径移动,然后以太快的速度渗透到大脑中,无法单独用扩散来描述[34,35,36,37,38,39,40].通常,对时间序列信号数据进行聚类分析,以显示不同脑区的造影剂摄取速度或造影剂运动的大致方向[17,34,41].最佳质量传输(OMT)模型已成为可视化鞘内造影剂通过大脑运动的绝佳工具[42].然而,这些半定量技术不允许确定独立于实验程序的表征分子运输的基本参数,也不能直接与已知的扩散速率进行比较。在这些DCE-MRI研究中,测量到的信号变化被认为是对比浓度的替代,假设浓度和信号变化之间成正比,当这种关系有些复杂时(见“方法”)。
以前预测基本参数的脑运输计算模型是在微观尺度上的,并且只能将结果与实验数据进行定性比较[20.,30.,31].Valnes等人是一个例外,他们开发了一个模拟人脑部分对比度传输的有限元模型[43],利用来自人体研究的DCE-MRI数据[44,45]来估计灰质和白质的传输参数。然而,人脑高度折叠表面的复杂性、研究参与者之间的可变性以及DCE-MRI数据的噪声性质导致结果依赖于边界数据滤波方法。在这里,为老鼠大脑的简单情况建立了一个有限元传输模型。老鼠的大脑皮层表面更光滑,白质较少,体积更小,可以对整个大脑进行建模,而小动物的MRI具有识别主要脑血管系统所需的分辨率。这使得沿着主要动脉周围导管的运输可以量化,这对整个大脑的分子运动是重要的。
在本研究中,采用简化的脑内运输有限元模型来分析DCE-MRI数据集,并确定描述整个脑容量宏观运输机制的基本参数。通过分析浓度的物理相关变量(由DCE-MRI信号计算),使用基于解剖标志和浓度动力学分割的受试者特定模型,并应用传输现象理论,我们旨在计算可直接与已知脑组织扩散率(\ (D_{应用}\)),并且与实验情况无关。我们的分析显示:(1)对流沿着主要动脉周围的优先路线,这与动脉周围流动的实验测量结果一致;(2)对流以较慢但显著的速率通过脑组织,包括较小的血管周围和间隙。
方法
这项工作的目的是利用质量传递理论分析DCE-MRI数据,以量化实验观察到的宏观溶质传输速率,即在整个大脑的尺度上,可以在实验之间进行比较,并直接与已知的扩散速率进行比较。通过对总体转运速率与已知扩散速率的比较,并利用目前文献中对脑转运的理解,可以得出不同解剖区域可能的转运模式的结论。这种方法提供了对淋巴运输特性的深入了解,包括对流流体流动是否是脑组织内分子运输的重要贡献者。
方法
根据公式,脑组织中分子的转运可能通过多种机制的组合发生。1,包括扩散、色散、对流和源或汇项(按公式右侧顺序给出)。3.):
在哪里c=浓度,\ (D_{应用}\)=表观扩散系数;\ (D_ {disp} \)=色散系数;v=表面速度(矢量场);\(s\左(c \右)\)=空间相关的源项(如注入)\(f\左(c \右)\)=吸收项(如细胞摄取、吸附、外排途径)。选择造影剂是因为其在中枢神经系统中缺乏生物活性,因此可以忽略细胞摄取和吸附。对于具有生物活性的分子来说,这些与细胞相互作用的过程会减慢运输速度。
式()中的对流项1)在描述宏观传输和利用分辨率仅为100 μm的数据时提出了一个挑战,因为它不能解决为整个大脑的流体传输提供主要管道的微血管。流体速度(v)在对流项中是一个矢量,这意味着它既有大小又有方向。液体流速,如淋巴理论所描述的,在单个体素内可能有几个方向——首先沿着动脉周围空间,这是分支性质的,然后穿过间隙从动脉周围到静脉周围,可能垂直于动脉周围流动,然后沿着静脉周围空间,这也是分支性质的。因此,在MRI体素分辨率下观察到的流体速度代表了这些速度机制的组合,导致造影剂在体素上的净传播比单独扩散更快。
尽管在一个体素内存在多向流体速度,但是否有可能使用DCE-MRI数据和由Eq建立的传输模型来确定解剖区域内的“净”速度大小?1?使用这种方法描述传输特性仍然需要一个单位矢量来描述每个网格元素的速度方向。当液体在大脑中流动时,沿着血管的分支网络并穿过间隙,它可能一个元素一个元素地改变方向。此外,MRI分辨率允许识别大口径血管,但不包含可能用于单位矢量假设的较小血管的信息。这种方法需要对速度方向做出不合理的假设,给计算增加了大量的不确定性。
从第一性原理建立一个模型来预测整个大脑的淋巴流动细节,并与DCE-MRI数据进行比较,这是否可行?根据淋巴理论,流体速度是由微观层面的机制驱动的,主要驱动因素是动脉周围的流动。如引言中所述,实验证据支持动脉搏动携带的动脉周围血流,然而观察到的动脉周围血流[18,19]还没有从假设这种机制的第一原理中预测出来[20.,24,26,27].事实上,使用迄今为止最复杂的计算模型,Daversin-Catty等人和Kedarasetti等人都证明,动脉脉动本身产生的净流量可以忽略不计,并且需要大约2 mmHg/m的静态压力梯度(或沿着5 mm MCA的0.1 mmHg)才能实现实验观察到的动脉周围流量[26,27].(实验观察到的椭圆动脉周围横截面[18],产生的水力阻力为圆截面的一半[46]在计算模型中使用,这将进一步减少所需的压力梯度多达一半)。尽管心脏周期产生如此大的静压梯度,但尚不清楚它是如何传递到动脉周围空间的液体中的[27].另一些人则认为,大脑内的静水压力梯度不足以产生观察到的流动[47].对于多孔介质的流动,达西定律可以很好地描述间隙流动(\(v = - k\nabla P\))。然而,动脉周围的压力驱动间质和静脉周围的流动是未知的。考虑到横跨大脑的血管网络的复杂性和目前动脉周围血流的第一性原理模型的局限性,目前预测整个大脑的流体流动是不可行的。
鉴于上述在宏观尺度上计算或估计流体速度的局限性,采用整体输运参数法:
当所有输运机制被“集中”成一个参数时,有效扩散率(\ (D_ {eff} \)),并且可以将该整体传输参数与造影剂的已知扩散率进行比较,从而得出有关其他传输机制的结论。有效扩散系数,\ (D_ {eff} \),表示在单个传输参数内的扩散、血管周围弥散、血管周围对流和间隙对流的复合。模拟运输\ (D_ {eff} \)在主导机制不确定的情况下,以前采用的一般方法是[43]来量化和比较中枢神经系统内的运输速率。这种简化的缺点是它迫使扩散的数学形式,所有的传输机制都集中在一个参数中。该方法的优点是:(1)所得到的问题相对简单,可以在复杂的几何形状中解决,几乎没有假设,(2)它只需要直接从DCE-MRI获得的浓度数据,(3)结果与已知的造影剂扩散率直接相当。考虑到围绕脑转运主题的模型和结果范围广泛,从扩散到弥散再到对流,对转运机制不可知是有利的[25].因此,考虑到大脑中对流流动的存在和驱动力的真正不确定性,简化模型非常适合DCE-MRI测量的脑运输的公正表征。
的\ (D_ {eff} \)将每个分节解剖体积的值与已知的表观扩散率(\ (D_{应用}\));
在哪里D= 0.016 mm2/分钟(48]为钆的自由扩散系数,λ = 1.6 [49]或λ = 1.85 [32]为弯曲度,表示多孔介质减缓分子传输的程度。从这些比较中,我们可以推断出对流和色散在运输模型中每个解剖子域的流行程度和大小。例如,如果存在明显的对流,则\ (D_ {eff} \)值的数量级将大于\ (D_{应用}\)值。
方法概述
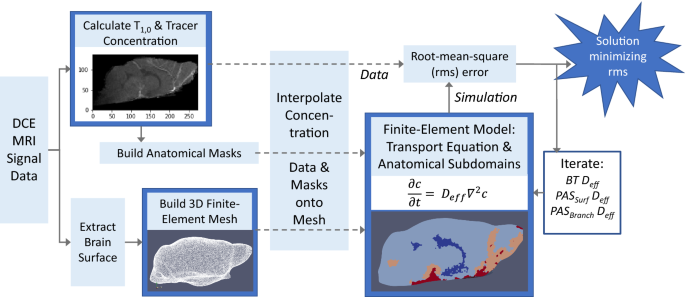
图中概述了使用有限元建模和DCE-MRI数据估计不同解剖区域的传输参数的过程。2.在高水平上,DCE-MRI信号数据用于计算造影剂浓度,并为与全脑运输相关的计算模型定义离散解剖区域。为整个小鼠大脑建立了特定主题的分子运输有限元模型,其中将独特的运输参数应用于每个定义的解剖区域。传输参数集各不相同,进行模拟是为了确定每个主题的参数的最佳组合,从而最大限度地减少浓度数据与模拟之间的差异。然后将计算出的传输参数与造影剂通过脑组织的已知扩散率进行比较,得出关于大脑不同区域对流传输的结论。
基于DCE-MRI数据的有限元建模脑转运分析示意图。DCE-MRI信号数据用于计算造影剂浓度和\ (T_{1, 0} \识别)这是一个用于识别不同类型组织的参数。对比浓度和\ (T_{1, 0} \识别)用于定义与全脑运输相关的区域的解剖掩模,包括心室系统、宏观动脉血管系统及其相关的血管周围空间。DCE-MRI数据也被用于提取大脑表面。每个实验对象的解剖面具都是独一无二的。从大脑表面构建一个三维四面体网格。浓度数据和解剖掩模被插值到网格上。利用简化的质量传递方程建立了一个有限元模型。2)和由解剖掩模定义的子域(图2)。3.)。每个子域都有唯一的有效扩散系数。对不同的有效扩散系数进行了模拟,以找到有效扩散系数的组合,使浓度数据与模拟之间的差异最小化
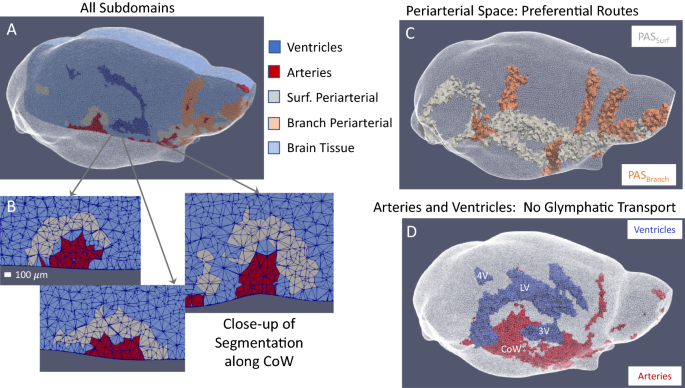
从MRI数据中提取的解剖细节定义了传输模型子域。结构MRI扫描和DCE-MRI数据用于在全脑有限元模型中构建子域。分析数据以确定全脑模型中每个子域的传输参数。一个受试者特异性,半透明白色的小鼠脑三维四面体网格(晶体脑)。矢状截面显示了有限元模型内的所有五个解剖子域。B动脉与动脉周围间隙的二维冠状面切面(垂直于(一个))沿着威利斯圈的左分支,其中的线条描绘了四面体网格顶点的边缘。动脉周围空间的宽度从3到9个顶点不等。由于动脉周围空间主要由浓度定义,因此有时在动脉和动脉周围空间之间存在一个或两个厚的缓冲点,这表明同一体素中可能存在一种或多种材料并影响测量信号的区域之间的边界(参见“误差来源”)。未含造影剂的动脉没有造影后信号改变,而造影剂浓度高的动脉周围空间造影后信号改变较大。中间区域是两者的组合,它在两者之间产生一个信号,从而将体素从动脉或动脉周围区域的定义中排除。C三维“水晶脑”图像的表面(浅灰色)和分支(桃红色)动脉周围子域。半透明的白色表示大脑的表面。D动脉(红色)和心室(蓝色)子域(侧脑室(LV)、第三脑室(3v)、第四脑室(4v)、威利斯圈(CoW))的3D“晶体脑”图像
DCE-MRI实验
本研究对先前发表的n = 4只雄性和雌性3-6月龄C57 Bl/6小鼠的DCE-MRI数据进行了分析[17].简单地说,氯胺酮/氯胺嗪麻醉(分别为100/10 mg/kg)的动物,以0.5 μl /min的速率,将10 μl 68 mM的gadoteridol造影剂(550 Da),通过手术通过寰枕膜插入到第四脑室和蛛网膜下腔(SAS)之间的输水管内。注射造影剂后,注入2µl生理盐水。在11.75 T下,小鼠俯卧位,间隔10分钟,80分钟,获得各向同性(100 × 100 × 100µm)体素的连续3D FLASH t1加权MR图像。每个受试者的图像序列使用线性刚体配准与基线图像对齐,然后屏蔽以去除非大脑区域(见附加文件)2),随后以60 × 60 × 60µm各向同性体素(FSL)对Badhwar小鼠海马图谱进行线性注册。由于本实验使用的高磁场,在对比度浓度高的地方和靠近颅骨等骨骼的地方,会遇到t1加权图像中T2/T2*效应的干扰。这些磁化率效应导致任何对比度增强都被受影响体素的强度降低所掩盖。
正如我们之前的研究所报道的那样,早期的造影剂增强发生在大脑的腹侧表面,之后整个脑组织的实质增强开始增加,在嗅球中观察到高浓度的增强,这是一种已知的淋巴外排途径。
对比浓度的计算和解剖区域的识别
为了量化传输参数,需要浓度——一个基本的物理变量。文献中大多数DCE-MRI数据作为信号报道和分析。测量信号的变化通常被认为是造影剂浓度的替代物,假设成正比。造影剂的存在使t1加权信号增强,但信号变化与浓度的关系更为复杂。Gadoteridol浓度与MRI信号的关系为[50]:
在哪里r1= Gadoteridol (Prohance)弛豫度,3.2 × 103L / mmol-ms [51].\ (T_{1, 0} \识别)=对比前松弛时间(ms)。\ (S_ {Gd} \)=注射造影剂后的信号强度(作为时间的函数,无量纲)。\ (S_ {0} \)=注射造影剂前的基线信号强度(无量纲)。
对比剂浓度与信号变化成比例的假设是正确的\ (T_{1, 0} \识别)在整个样本中都是常数。然而,\ (T_{1, 0} \识别)依赖于分子环境,在生物主体的不同组织中差异显著(500-4500),特别是像大脑这样复杂的组织。\ (T_{1, 0} \识别)可根据不同翻转角度采集的基线MRI信号,根据下式[52]:
在哪里TR=重复时间(此处报道的实验为16 ms), α =翻转角度。
对于每个体素,\ (T_{1, 0} \识别)是由\ (S_ {0} \)(基线)图像在α= 3°和15°使用曲线拟合的Eq。5.知道\ (T_{1, 0} \识别),情商。4用于从DCE-MRI信号中计算每个体素和时间点的加多啶醇浓度。计算出的浓度[gadoteridol]是表面浓度(\(\眉题c {} \))用于多孔介质理论,其中\(\overline{c} = c \cdot \phi\)和∅是孔隙率或孔隙率。假设整个大脑的空隙率是恒定的;∅众所周知,其价值约为20% [1,49对于大多数成人脑组织来说。在整个文本中,对表面集中的强调已被删除,它被简单地表示为c.
在仔细检查浓度数据后,可以观察到明显不同浓度动态的区域。这些区域与大脑的解剖特征相关,在所有实验对象中都能观察到。浓度和\ (T_{1, 0} \识别)阈值用于开发掩模,即分配给特定特征的体素,将大脑分割成显示不同浓度动态的体积。自\ (T_{1, 0} \识别)在不同类型的组织之间差异显著,它可以用来识别解剖特征,如血管和心室。使用\ (T_{1, 0} \识别),分段的卷(在“结果)被证明与解剖学特征有关。
有限元模型
基于简化的输运方程(Eq. 1)建立了小鼠脑内输运的三维有限元模型(fem)。2)。为4只不同的小鼠建立了全脑(颅骨和蛛网膜下腔除外)的被试特异性模型,该模型被分割为5个解剖体积或子域。每个解剖子域的有效扩散率不同,以确定与DCE-MRI浓度数据最一致的参数的最佳组合。
为了构建有限元网格,使用MRIcroS从MRI数据中提取脑表面[53].使用Meshlab对产生的表面缺陷进行修复[54].用gmsh[]生成了约90万个四面体单元的体积网格。55].使用反距离加权(IDW)方法将解剖掩模插值到网格上,以定义全脑网格内的解剖子域。时间序列对比浓度也被插值到网格上进行误差计算。IDW方法本质上是高斯滤波的应用,因此也具有局部平滑数据的效果。
简化的输运方程(Eq。2)用有限元法在整个小鼠大脑的复杂几何结构中求解。有效扩散系数,\ (D_ {eff} \)的值在每个子域中都是恒定的,但是每个子域可能有不同的\ (D_ {eff} \)价值。对比剂注射发生在实验的前20分钟,在空间上被建模为点源,在时间上被建模为矩形函数。尽管大脑表面的浓度数据是最准确的边界条件,但任何对比度增强都被附近头骨产生的强烈的局部T2/T2*效应所掩盖,这降低了强度,使数据在外表面1到3体素的厚度范围内无效(见附加文件)2)。(老鼠大脑的SAS非常狭窄,导致大脑和头骨之间的屏障很小。)考虑到头骨是一个不可穿透的屏障,除了像脊柱开口这样的离散位置外,应用了无通量边界条件。虽然一些造影剂会通过脑脊液和淋巴外排途径离开大脑,但假设这种损失在DCE-MRI实验的短时间内很小。
通过使用DCE-MRI数据计算的浓度计算脑内加多啶醇的总量与时间的关系,来检验无通量边界条件的适宜性。如果无通量边界条件准确地代表了物理情况,那么在注射过程中,大脑中Gad的总量将在前20分钟增加,然后保持不变。根据DCE-MRI数据计算,在整个实验过程中(长达84分钟),4只小鼠中有3只小鼠的大脑中gadoteridol的总量增加或趋于平稳,这与造影剂没有通过边界损失或没有通量一致。随着时间的推移,观察到的gadoteridol总量的增加是T2/T2*干扰高对比度浓度下t1加权对比度增强的产物,这在早期时间点的计算中排除了注射部位附近含有相对大量gadoteridol的几个体素(约10,000体素)。随着时间的推移,对比度分散,受T2/T2*干扰影响的体素数减少,将先前“隐藏”的gadoteridol添加到总计算中。
有效扩散系数在子域之间存在差异,均方根误差(rms)之间的数据和模拟映射确定的集合\ (D_ {eff} \)产生最小的误差。
排除注射部位附近T2/T2*干扰区、心室、血管的误差计算。误差计算采用52min以内的时间点,由于假设没有外排路线和无通量边界条件,为了使误差最小化,排除了之后的时间点。
方程2用FEniCS近似求解[56,57],一个采用有限元方法求解偏微分方程的开源求解器,使用二次元(拉格朗日)网格单元和线性方程组的预置迭代求解器。时间导数采用后向差分(即隐式欧拉法)离散化。在Amazon Web Server (AWS) c5实例或具有i9处理器和32gb RAM的MacBook Pro上,每个有效扩散系数集的解决方案需要2-3小时。50到200种组合\ (D_ {eff} \)对每个受试者进行模拟以生成误差面,由此确定导致最小均方根的值(参见附加文件2)。使用Python对模拟和DCE-MRI浓度数据进行后处理[58], Paraview [59]和Excel。尽一切努力使用开源软件。
结果
运输区域的分割
仔细评估三维时间序列DCE-MRI实验数据揭示了几个具有明显浓度动态的增强区域,这些区域与脑动脉血管系统和脑室系统的解剖结构一致。在所有受试者中,对比剂从脑后部的注射部位沿着腹表面的大动脉移动,然后围绕主要分支动脉,并从这些优先路径进入实质。基于这些观察结果,使用对比前基线图像和DCE-MRI数据将每个大脑单独分割为五个体积:(1)脑室,(2)宏观脑动脉血管系统,(3)主要表面动脉周围的动脉周围空间,(4)主要分支和穿透动脉周围的动脉周围空间,以及(5)脑实质的其余部分。3.A).在主要静脉结构周围没有观察到造影剂,事实上,在小鼠和大鼠中静脉结构最普遍的大脑背侧几乎没有观察到示踪剂。静脉结构附近缺乏造影剂可能是由于:(1)造影剂尚未到达主要静脉结构,或(2)到达主要静脉周围间隙后,造影剂被迅速转移,其浓度仍然很小。上面列出的五个分段用于在有限元模型中创建子域,为其确定唯一的传输参数。
MRI采集得到各向同性的100 μm体素,通过图谱配准插值到60 μm各向同性体素,提供了足够的分辨率来分割近端动脉血管。可识别的表面动脉包括威利斯圈(CoW)、基底动脉(Bas)和大脑前动脉(ACA)的交通动脉(图2)。3.可识别的分支动脉包括大脑后动脉(PCA)、大脑中动脉(MCA)和嗅觉动脉(OAs)(图3)。3.D)。
根据其独特的浓度动态来确定动脉周围空间,并因其位置而被命名为动脉周围。在早期时间点观察到高造影剂浓度的周围表面和分支动脉,描述了主要的动脉周围空间。围绕表面动脉的动脉周围空间(PAS)冲浪)和分支动脉(PAS)分支)(图。3.B和C)通过高对比度浓度([gadoteridol] > 0.15 mM at t = 20 min)和接近度(≤7体素的PAS)来定义冲浪PAS≤3体素分支)到大动脉(T1, 0< 1000-1400(取决于受试者)从基线(对比前)MRI扫描确定。
几个研究小组已经确定了通过蛛网膜下腔的表面动脉周围示踪剂运动的优先路线[41,60,61].这些优先通道的解剖学细节一直存在争议,然而,与解剖学无关,它们被称为动脉周围空间[41].Harrison等人进一步证明,这些优先通道的流体流动既平行于动脉又接近动脉[62].Pizzo等人展示了大脑腹侧表面大动脉周围优先路径的荧光和DCE-MRI图像,这与本研究中定义的表面动脉周围空间的分割相似[41].分割模型中的动脉周围空间不一定代表解剖上的动脉周围空间,但与Mestre等人所描述的优先运输路线的结构和宽度有很好的相关性。18和Tithof等人。[46]并被这些组确定为动脉周围的PVS(见附加文件)2)。此外,在淋巴模型中,分割的动脉周围体积为优先运输路线确定为动脉周围空间。
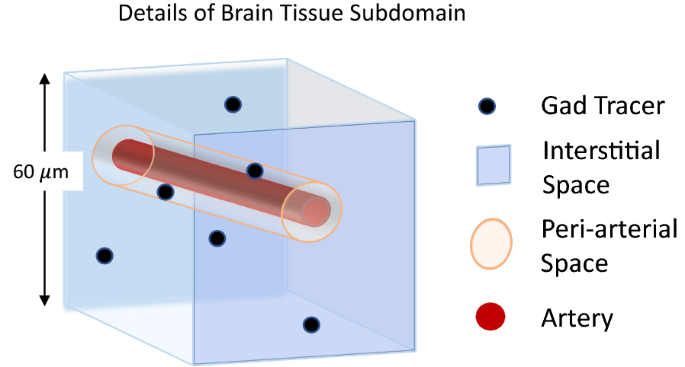
在60µm分辨率下,较小的动脉和微血管不能从较宽的脑间质中单独分离出来,因此被集中到脑组织体积的体素中(图6)。4)。因此,\ (D_ {eff} \)估计脑组织体积会在间质和小的PVS(动脉周围和静脉周围空间)中聚集或合并运输。造影剂进入动脉和穿过脑室壁(脑室内脑脊液室和周围脑组织之间)的运输微不足道,这些区域的运输参数极小(脑组织区域的0.000001%)。因此,基于上述分割,目前的模型定义了全脑运输中三个关键区域的最佳参数:PAS冲浪, PAS分支和剩余的脑组织(BT),结合间质和小血管周围空间。
脑组织子域中单侧尺寸为60 μm的DCE-MRI体素的简化图(图中浅蓝色)。3.A).脑组织子域中的每个体素都包含间隙空间和太小而无法通过MRI分辨的PVSs。因此,为该子域确定的传输参数结合了间隙空间中的传输和pvs
交通参数
平均\ (D_ {eff} \)(和标准差)的每个解剖子域报告在表中1.的\ (D_ {eff} \)对于每个子域都大于\ (D_{应用}\)这表明在整个大脑中,转运比单纯的扩散要快。的估计价值\ (D_ {eff} \)主要动脉间隙(PAS冲浪,不是分支),它们的价值大小相似。事实上,\ (D_ {eff} \)动脉周围的速度比\ (D_{应用}\)(> 10000倍快),沿着主要血管的动脉周围运输只能用对流来解释。据预测,主要动脉周围空间的弥散会使运输速率比扩散速率增加两倍[20.].Asgari等人假设动脉周围空间是多孔的,而脑表面动脉周围空间的运输已被证明与开放、无多孔通道的运输一致[46].在开放的通道中,预测的色散可能更大,但仍然只占观测到的增强的很小一部分。在畅通无阻的空间中运输,如明渠,\ (D_ {eff} \)与自由扩散系数(D)。\ (D_ {eff} \)主要动脉周围间隙的速度大于1000xD,也表示对流。
在BT亚域,它结合了间质空间和与较小的脉管系统和微循环相关的PVSs,整体运输的增强(\ (D_ {eff} \)) /\ (D_{应用}\)体积较小(10 - 25倍),但仍然支持组织内部对流的存在。如上所述,\ (D_ {eff} \)BT体积的大小代表了扩散、动脉周围对流、动脉周围弥散、间质对流和静脉周围对流的组合。对于像gadoteridol (550 Da)这样的小分子,预计间隙对流和扩散具有相似的速率[32].弥散也可以在较小的动脉周围空间内增强运输,然而,如上所述,它的贡献不太可能高到足以说明剩余的全部增强\ (D_ {eff} \)在BT子域内\ (D_{应用}\).因此,很大程度上增加了\ (D_ {eff} \)在\ (D_{应用}\)与Cserr等和Rennels等人的观测结果一致,BT体积中观测到的温度可能归因于沿较小穿透性pv的对流。[6,7].
有效弥漫性是一个体积平均值,而血管周围空间仅占脑体积的一小部分,这意味着与单独扩散相比,小PVS中整体运输的增强可能比组合脑组织区域的增强要大得多。脉管系统平均约占脑总容积的3%。如果假设血管周围空间也约为脑容量的3%,基于pv与其周围血管的横截面积相似[18],然后,在减去间隙对流和动脉周围弥散后,\ (D_ {eff} \)脑组织中PVS对流造成的损伤估计为3mm2/分钟。这个小的PVS传输速率比600x的快\ (D_{应用}\)并且比动脉周围空间的运输少约20x / s,表明血管周围的血流继续进入脑实质,可能比动脉周围的动脉周围空间慢。目前尚不清楚脑实质内的血管周围空间是否具有多孔性,是否可能充满细胞外基质[20.,25].然而,这种快速运输表明pv通道是开放的(而不是多孔的)。
模拟比较
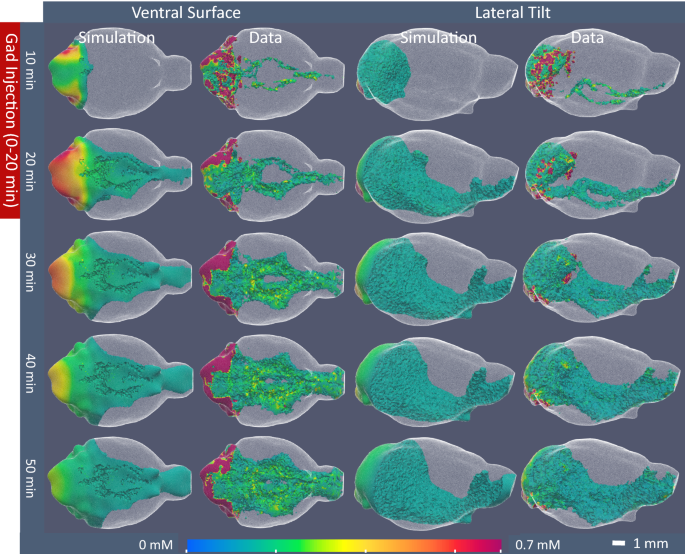
数字5显示了模拟的浓度轮廓,与代表性小鼠的DCE-MRI数据计算的浓度相比(见附加文件)1用于3D动画和附加文件2二维切片)。造影剂的进展与其他研究中观察到的后侧注射部位相同[34,35,36,37,38,39,40[1]造影剂沿脑腹侧表面沿表面动脉快速移动,在不到10分钟的时间内到达大脑前部;(2)造影剂沿分支动脉进入脑实质;(3)造影剂从这些主要的动脉周围通路进入周围脑组织。考虑到模型的简化,浓度模拟在视觉上与实验数据很好地匹配。然而,在模拟中,造影剂在早期时间点向大脑前部移动的速度并不快,与观察到的实验分布相比,造影剂浓度> 0.1 mM在大脑后部所占的体积仍然更大。这种差异是对流传输建模的结果,对流传输与浓度梯度具有一阶关系(Eq。1),使用扩散模型,该模型相对于浓度梯度是二阶的(Eq。2)。一个二阶模型,例如在模拟中使用的模型,将在对比源(后脑)附近产生更高的浓度,并在向前移动时更快地下降,而在一个一阶模型中,例如在全传输方程中的对流模型,浓度将遵循线性下降。对比剂浓度数据与尾尾距离之间的一阶关系是支持动脉周围对流的额外证据。
模拟与实验DCE-MRI加多啶醇浓度数据的比较。图像对比浓度与时间的模拟结果的代表性小鼠使用分割如上所述,和最佳运输参数(脑组织\ (D_ {eff} \)= 0.1 mm2/分钟,不冲浪\ (D_ {eff} \)= 95毫米2/分钟,不分支\ (D_ {eff} \)= 60mm2/min),与DCE-MRI信号数据计算的浓度相比。3D图像仅显示浓度大于0.1 mM的元素,并根据图底部的色条按浓度着色。图中显示的是腹面和侧位图像,图像稍微向下倾斜,显示腹面威利斯环周围的细节和分支动脉。在数据图像中,观察到造影剂从靠近池导水管的注射部位向外移动,沿着威利斯圈的交通动脉沿着大脑腹侧表面快速移动。然后,造影剂沿着主要的动脉分支进入大脑,并从这些优先途径渗透到更广泛的脑组织。心室系统中的对比已经从图像中删除,以便与模拟进行直接比较,模拟仅模拟淋巴运输(不模拟心室运输)。在模拟中,对比运动遵循相同的进程,尽管它在早期时间点向前脑移动的速度不如实验数据中快,并且在后脑区域仍然比实验数据中高
对模拟和实验数据进行更精确的检查(图2)。5和附加文件2)表明,在稍后的时间点,实验数据表现出造影剂浓度的异质性(例如,明显的高浓度和低浓度区域),而在模拟中,造影剂浓度在组织中平稳下降。这种平滑的扩散是扩散模型的预期结果。2)。因此,考虑到所选择的模型和在这项工作中进行的解剖简化,这种差异是意料之中的。在较晚时间点测量的对比剂浓度的异质性表明,脑组织比模型更具异质性,这种解剖学异质性背后的运输机制也是如此。当然,模拟和实验数据之间的局部一致性可以通过包含更多的解剖细节来改善。然而,这些细节的增加增加了复杂性,并且需要更多的可调参数,这削弱了量化参数的有用性,增加了新的潜在误差源,并且需要非常大的计算资源。虽然该模型不能完美地模拟实验数据,但从该模型确定的参数很好地描述了整个大脑的宏观运输机制。
讨论
长期以来,DCE-MRI实验已经报道了脑内转运似乎比单独扩散更快,但这种转运速率尚未被量化到一个物理相关值,可以与已知的造影剂扩散速率进行比较。有效扩散系数(\ (D_ {eff} \))比造影剂在脑组织中的扩散率(\ (D_{应用}\)),因此表明对流是整个大脑运输的重要贡献者。在这个讨论节,\ (D_ {eff} \)使用传输现象的概念进一步分析结果,并将分析结果与文献中报告的值进行比较。进一步探讨了影响输运的实验因素以及分析和实验的误差来源。
运输机制
模数(体育)是一个无量纲组,用于评估对流传输速率对扩散传输速率的相对重要性:
如果运输主要是通过扩散(即,在停滞的流体中通过随机分子运动),那么体育≪1、如果输送主要是通过对流(即通过散装流体运动),体育≫1。因为不确定血管周围空间是开放的还是多孔的,体育两者同时计算D和\ (D_{应用}\)分别。表格1报告体育对于每个解剖区域使用D= 0.016 mm2/分钟,\ (D_{应用}\)= 0.005 mm2/分钟(Eq。3.),\(D_{disp} = D_{app}\)[20.].在两个主要动脉周围空间(PAS)冲浪并不是分支),它们被认为是开放的,体育超过1000,对流(或散装流)是主要的输送机制。脑组织(BT)由间质组织和与小血管相关的PVSs组成,表现出一种中间产物体育= 18,其中对流和扩散都是相关的,但对流仍然是造影剂更大的运输机制。从psamiclet分析中,我们得出结论,对流存在于更宽的脑组织体积内,并且对运输具有重要意义,但是其每个生理成分(大块间质与微血管PVS)的贡献是不可确定的。
同样重要的是要注意在DCE-MRI研究中使用的造影剂的运输特性。选择造影剂是因为它不与细胞相互作用,并且在中枢神经系统中没有已知的载体或转运体;它没有生物活性。因此,它的传输不会因生物相互作用而减慢,并且表明了扩散、弥散和对流的纯传输机制。生物活性分子将被细胞和转运体的相互作用减慢,其产生的速率是分子特异性的。在DCE-MRI数据中观察到的和本文分析的传输速率应该被认为是gadoteridol大小(559 Da)周围分子传输的上限。与生物大分子(包括与神经变性相关的肽和蛋白质,如β淀粉样蛋白(4.5 kDa))相比,Gadoteridol的分子也更小。这些大分子有小分子\ (D_{应用}\),因此更大体育这意味着这里观察到的对流将对这种大分子的整体运输产生更大的影响。
平均速度
使用psamclet数(式)的定义。7)和每个地区运输的特征长度,\ (D_ {eff} \)可用于估计平均流体速度(v),每个地区的数据见表1.据估计,动脉周围对流的平均速度为\ (v_{不是}\)= 8mm /min冲浪和\ (v_{不是}\)= 12mm /min分支.特征长度的选择对计算速度有重要影响。利用计算特征传输次数的惯例,估计了各解剖区域主要传输方向上的特征长度。特征长度报告在表中1PAS冲浪并不是分支是根据大脑在每个方向上的长度尺寸来选择的(对于PAS冲浪PAS为腹-背侧分支)。由于PVS之后的血管系统是弯曲的分支路径,并且从大动脉向下连接到毛细血管,因此动脉周围区域的适当特征长度可能比估计的要长,这将导致较低的速度。Mestre等人和Bedussi等人测量了沿MCA(及其直接分支)特定位置的血管周围流体速度为1.2 mm/min。18,19].测量到的速度比我们分析中估计的速度慢,但在数量级上是相似的。速度值的差异可能源于:(1)小化学示踪剂和粒子之间的传输差异,(2)动脉周围空间系统的平均速度计算与特定位置的粒子速度测量,和/或(3)分析和实验中的误差来源。
BT体积代表了小血管周围的间质运输和血管周围运输的结合(如图2所示)。1&3.B).因此,研究了每个的文献值,并与估计的平均速度进行了比较\ (v_ {BT} \)= 0.1-0.3 mm/min(表1)。在之前的工作中,Ray等人估计脑内的间隙流(预计是这里考虑的所有解剖区域的最低速度)大约为\ (v_ {} \)= 0.01 mm/min [32].通过脑外组织(外周)间质血流的测量,可能代表脑间质运输的上限\ (v_ {} \)= 0.006-0.12 mm/min [63].这两种估计的间隙速度都比从数据中估计的平均速度低一个数量级\ (D_ {eff} \)在总BT体积中,表明pv流可能有重大贡献。
考虑脑组织区域速度的另一种方式是传输“锋”的速度。较小的穿透性动脉和微血管向多个方向分支,因此无论是在穿透性动脉周围和静脉周围间隙,还是从动脉周围到静脉周围间隙的间质流动,在BT体积的尺度上都可能没有明确的流动方向。相反,对比的发展比单纯的扩散更快,但却是沿着曲折的对流路径。因此,计算出的速度见表1,\ (v_ {BT} \)= 0.1-0.3 mm/min,可以更好地描述为“前部”进入大脑深处的速度,而不是实际的间质或血管周围流动的速度。Plog等人在大血管之间的空间中测量了大约0.1-1 mm/min的前速度(类似于本工作中的BT体积)[64].这个锋面速度,还是一个增强因子\ (D_ {eff} / D_{应用}\),可能更好地代表了脑组织中动脉周围对流、静脉周围对流、间质对流、弥散和扩散的综合作用。
上述结果均适用于主要分支动脉(PAS)的动脉周间隙分支)和较小的穿透性动脉的动脉周围空间(包括在BT体积中)支持动脉周围血流沿着穿透性动脉继续进入大脑。Mestre等。[18]和Bedussi等人。[19[报道]在动脉周围空间中追踪流体运动的1 μm微球被排除在该动脉进入大脑的较小分支中。这一观察结果提出了这样一个问题:动脉周围的血流是否继续进入大脑,如果是这样,穿透性动脉周围的空间是否充满了像多孔介质一样的蛋白质网络,阻碍了血流。在模型中,PAS分支由主要位于大脑表面的中动脉的PVS组成,还包括大脑后动脉(PCA)和进入脑组织的OAs。对流沿PAS的大动脉是明显的分支其量级表明是明渠流动,而不是通过多孔介质流动。微血管空间也支持对流。尽管在全脑范围内进行的分析无法确定小动脉和静脉的血管周围空间的实际流速,但穿透性脉管系统周围明显的血管周围流动可以最好地解释这一结果。因此,本文报道的结果与目前文献的理解相结合,支持沿大穿透性动脉的开放通道动脉周围流动和沿可能是开放通道或多孔介质流动的较小脑血管的血管周围流动。
试验因素对输运率的影响
尽管DCE-MRI被广泛用于评估脑内溶质运输,但影响淋巴运输的因素仍在研究中,实验技术仍在标准化中。可能影响DCE-MRI实验测量的类淋巴转运率的实验参数包括:造影剂输注程序、身体姿势和麻醉。首先,通过手术将移液管插入大池(CM)来完成造影剂的注射,大池是大脑周围充满脑脊液的蛛网膜下腔(SAS)的加宽处,注射速度在几分钟内得到控制。Lundgaard等人报道,在脑脊液流出颅骨的条件下,CM穿刺导致淋巴功能下降[65].淋巴功能的下降被认为是颅内压下降的结果,而不是穿刺本身。在DCE-MRI实验中,移除针头/移液器的同时,用氰基丙烯酸酯胶密封硬脑膜。因此,虽然取针打开CM确实会损害淋巴功能,但此处应用的封闭方法可以维持正常水平的淋巴功能,就像针头留在原位时观察到的那样。
其次,身体姿势已被证明会影响小鼠大脑的转运速率,侧卧位的转运速率最高,仰卧位的转运速率高于俯卧位[66].啮齿类动物自然地成群睡觉,这可以导致各种各样的身体姿势[33].基础淋巴实验(DCE-MRI前)在俯卧位进行[6,7,10,34],文献报道的DCE-MRI图像是在俯卧位或仰卧位获得的[17,33,34,67,68],或职位未被报道[39,69].根据使用双室模型计算的造影剂潴留率和损失率,俯卧位的脑运输比仰卧位慢40%,侧卧位的脑运输速度约为侧卧位的一半[66].本分析中使用的DCE-MRI数据是从俯卧位的小鼠中收集的,因此传输可能比仰卧位收集的数据慢。
最后,已知麻醉类型会影响脑运输速率[35,36,37,38,39,70].文献中大多数DCE-MRI实验使用异氟醚[33],这是MRI中标准使用的可吸入麻醉剂,而少数使用氯胺酮-二嗪(K-X),这是许多研究淋巴系统的基础实验(在DCE MRI之前)的标准。特别是,Xie等人证明K-X在类淋巴活性方面模拟自然睡眠[10].Stanton等人最近证实,异氟醚和K-X麻醉方案之间的对比转运途径不同[71].具体来说,使用异氟醚时,由于造影剂快速流出进入椎管和沿颅神经鞘,对实质的穿透性较差。在K-X麻醉下,造影剂分布到脑实质,运输到嗅球(一个主要的外排途径),或沿椎管运输[71].在本分析中使用的实验中,小鼠在氯胺酮-二嗪(K-X)麻醉下。因此,这里估计的传输速率预计比使用异氟醚麻醉收集的数据要快。
误差来源
分割
为了估计显示不同运输动态的脑区域的运输参数,全脑模型被分割成由对比前图像和/或对比浓度确定的解剖特征定义的体积。DCE-MRI测量每个体素中包含的体积的平均信号。因此,在分割体之间的边界处,一个体素可能包含多个解剖特征,测量的信号是每个特征产生的信号的平均值。由于100 μm的体素大小或分辨率对于解剖特征非常重要,因此在分割体积的边界处,不同组织的“混合”是不可避免的。例如,会有一部分脑组织包含在动脉周围容积中,反之亦然。边界处的这种“混合”可能是估计单独输运参数的误差来源,因为特征之间没有明确的划分,而从边界附近的信号计算的浓度包括每个特征的贡献。
Valnes等人在使用有限元模型分析人脑运输时,由于SAS CSF和大脑交界面组织之间的“体素平均”,他们经历了严重的并发症[43].由于造影剂是在鞘内注射的,因此通过从CSF进入脑组织进入大脑,因此脑脊液/脑界面的浓度对其建模至关重要。在本文分析的数据中,造影剂直接注入脑容量,因此分析结果与准确的脑表面造影剂浓度之间的依赖性较小。在这里分析的小鼠实验中,数据中的错误存在于大脑表面,但它们的来源并不是分割错误。在老鼠的大脑中,表面信号被来自头骨的局部T2/T2*效应的干扰所掩盖,头骨比人类更接近大脑(见“方法和附加文件2)。DCE-MRI数据显示,在整个时间过程中,大脑表面的信号极低,厚度约为1至3体素,证实了这种干扰。如果在脑周围的脑脊液中存在造影剂,则预计从表面到脑组织的浓度梯度。然而,对地表附近浓度梯度的分析(见附加文件)2)显示在SAS CSF中没有造影剂的证据。受影响的表面体素包含在模型的脑组织区域中,增加了模拟与数据之间的误差。然而,该误差在不同的有效扩散系数中相对一致,因此不太可能影响从最小误差确定的最佳有效扩散系数结果。
相对于传输区之间的其他界面,BT体积占总体积的99.9%以上(按顶点数计算),因此,在其边界处纳入BT体积的任何PAS浓度动态可能对估计的BT影响很小\ (D_ {eff} \).估计\ (D_ {eff} \)PAS冲浪并不是分支体积明显大于BT\ (D_ {eff} \)(> 600×s),因此,在边界处纳入PAS体积的任何BT浓度动态也可能几乎没有影响。综上所述,尽管DCE-MRI测量的分辨率限制了特征的精确分割,但这种限制不太可能影响传输参数的估计,因为在共享边界的区域之间传输参数的估计存在显著差异。
运输模型
脑内运输是一个复杂的、动态的相互作用的一部分,涉及脉管系统(动脉、静脉和微血管)、脑脊液循环、脑组织、液体/溶质交换和颅/脊髓连接。输运可能受到脉动的影响[9,18], cycles [27]和电波[72],相对于正在分析的DCE-MRI数据,时间常数较短。本研究的目的是估计描述整个大脑宏观尺度上的一般运输的基本运输参数,以便更好地了解整个大脑中分子运输中对流或弥散的流行程度和大小。我们的目标不是建立一个包括脑传输和解剖学细节的机制模型,而是通过应用传输现象的严谨性来确定物理相关的传输参数,从而改进当前DCE-MRI数据的分析。为了在分析数据时不偏向输运机制,对输运方程进行了简化,将所有输运机制压缩为一项;为了建立一个计算上可行的模型,大脑的解剖特征被大大简化。虽然包括额外的解剖子域(具有独特的\ (D_ {eff} \))会导致模拟和数据之间的一致性得到改善,但也会导致额外的可调参数,从而削弱结果的有用性。简化的模型产生了参数估计,这是对当前分析方法的改进,并提供了对运输路线和机制的理解,这将有助于为未来更严格的运输模型铺平道路。
简化的输运方程也强制扩散输运的数学结构。对数据和模拟的仔细比较表明,浓度与距离之间的关系,特别是在血管周围空间,更符合对流的数学形式。具体地包括所有的输运机制,如式所示,可以大大改进模型。1.然而,在全脑范围内建立对流模型所需的信息(例如,驱动生理流动的压力梯度)目前尚不清楚。或者,可以通过实验测量对流场,可能是通过体素内非相干运动(IVIM) MRI [73].速度场可以直接应用于有限元网格,传输模型可以用来回答关于脑传输的更微妙的问题,即理解外排路线或建模疾病状态。
运输模型假设沿脑表面无通量边界,不包括造影剂流出脑容积的外排路线。尽管颅骨表面的大部分都是不可穿透的(无通量)屏障,但它也有特定的流出途径,即脊髓、颅神经和嗅觉神经以及脑膜淋巴管。检查未遮盖的DCE-MRI数据显示沿脊髓存在造影剂,特别是在早期时间点。对比剂在脊髓中的损失很难量化,然而,脊髓中的信号远小于注射部位周围的实质或表面和穿透性动脉周围的信号,也小于这些动脉周围间隙周围的实质中的对比剂浓度。
在淋巴模型中,假设液体和分子通过主要的静脉周围间隙离开脑组织,最终排空到血脑屏障外的颅外淋巴管[8].正如“结果”部分所讨论的,没有观察到位于小鼠大脑背侧的主要静脉通道周围的对比,因此没有数据可用于说明沿着这些特定通道的运输。此外,淋巴外排途径尚不清楚,因此需要继续研究[22,25].
如果在实验的时间尺度上,通过无通量边界的外排或损失对运输具有重要意义,则预计在注射完成后,脑内示踪剂的总量将稳步减少。然而,根据DCE-MRI数据进行的计算显示,在分析中使用的时间点(0-54分钟),四名受试者中的三名的加多啶醇总量没有减少,这支持了外排可能不是在所调查的时间尺度上运输的重要贡献者。随着对外排机制的了解越来越清楚,可以在模型中加入分布式外排或特定路线,以改善其对物理情况的表示,并允许分析更长的时间序列数据。
DCE-MRI实验
尽管MRI是一种强大的实验工具,但它本身就是一种低信噪比的噪声技术。在活体生物实验对象中,这种噪音会因组织中的微小运动而加剧,比如血液在血管中流动,或者整个实验对象的运动。MRI数据通常被过滤以减少噪声和平滑数据,但代价是在相对于解剖细节而言被认为较大的区域上平均数据。为了研究运输与特定解剖特征的相互作用,我们决定不过滤数据。(由于将MRI数据插值到有限元网格上,出现了一些最小的高斯滤波。)使用未经过滤的数据的后果是空间和时间点之间的变异性更大,导致模拟和数据之间的误差更大。然而,所有的参数组合都经历同样的噪声,并且传输参数给出了模拟和数据之间最小的差异,这是相对的,不应该受到很大的影响。
本分析中使用的DCE-MRI数据在高对比浓度下显示T2/T2*干扰,牺牲了注射部位附近的有用数据。优化了DCE-MRI实验参数(即磁场和脉冲序列),以测量低浓度的gadoteridol,以便跟踪其深入组织并可能阐明外排途径。特别是T2/T2*干扰掩盖了从注射部位到腹表面动脉周围组织的快速运输路径,增加了PAS的不确定性冲浪模型中使用的几何图形。T2/T2*干扰更有可能增加可变性,而不是导致更高或更低的值\ (D_ {eff} \).
实验前20分钟以0.5 μl/min的剂量注射造影剂是否会引起对流?28].Xue等人建立了小鼠1-2 μl/min的输注速率是安全的,并且仅与颅内压(ICP)轻微的短暂变化相关[74].Raghunandan等人通过比较示踪剂研究与传统输注技术(将示踪剂溶液缓慢注入脑脊液)和以与示踪剂溶液注入速度相同的速度从头盖骨中取出脑脊液的研究,直接解决了这个问题。75].实验结果,小鼠的动脉周围速度是用与Mestre等人相同的方法测量的[18],在统计上这两种情况是相同的。Raghunandan等人使用的输注速率比本文报道的DCE-MRI实验的输注速率高4倍。此外,Bedussi等人[19在本实验中使用的输注速率为70%时,观察到颅内压(ICP)未增加(脑脊液压力保持在输注前ICP范围内)。因此,已发表的实验结果支持,在本文分析的DCE-MRI实验中使用的输注速率下,对流不是示踪剂输注的伪影。
本研究中建立的模型也有助于评估这一问题,但当前数据的分析受到注射部位附近重要区域T2/T2*干扰和注射过程中数据集较少的限制。即使有这些限制,模拟也不一样\ (D_ {eff} \)输注期间和输注后的参数集存在电位差异,但仍表明在大动脉周围的pvs中存在明显的对流,输注后脑组织区域的转运速度比单纯的扩散快。
系统效率
最后,将传输参数值作为一个整体进行分析。建构理论,已被用来分析生物系统的效率[76,77],表明自然系统随着时间的推移而优化,并围绕分配给“系统功能”(功能空间)的空间约束进行优化。在优化后的自然系统中,跨功能空间的输运将是限速步骤,即系统中具有最长的特征输运时间(τ),而剩余的“流动系统”将围绕功能空间进行优化。对于淋巴系统来说,功能空间是间质空间,营养物质被输送到细胞,废物被带走,而PVS则构成了流动系统。使用\ (D_ {eff} \)和上面讨论的特征长度,小分子(100 Da)的间隙空间τ约为3分钟,大分子(1000 Da)的间隙空间τ约为13分钟,而大动脉周围空间τ = 1-3分钟,小动脉周围空间τ = 2-5分钟。对于小分子的运输,τ在每个“步骤”中都是相似的,表明整个系统是优化的。对于大分子的运输,正如预测的那样,间隙空间是限速的,可能受到大分子固有的缓慢扩散性的限制,以及脑细胞所能容忍的最大流速的限制,流动系统更快。
结论
使用简化的有限元传输模型,定量分析小分子gadoteridol (550 Da)在整个小鼠大脑中的传输的DCE-MRI数据表明,整个大脑存在对流。对流在主要表面动脉和分支动脉的动脉周空间中占主导地位,其中体育> 1000。重要的是,据估计对流会继续进入脑组织,这表明对流不仅仅是一种表面现象。由于DCE-MRI数据缺乏分辨能力,较小的穿透性血管的血管周围对流无法与间隙对流区分开。然而,与间隙血流和动脉周围弥散度的估计值和上限值相比,表明血管周围空间的液体流动分散在整个脑组织中。据估计,薄壁组织内的对流与gadoteridol等小分子(550 Da)有关,并且对涉及神经退行性疾病的大分子的整体运输具有重要意义。
本研究中描述的全脑传输模型在量化基本传输参数(而不是任意单位的传输速率)方面比以前的DCE-MRI分析方法有了改进,可以直接与已知的扩散速率进行比较。目前形式的模型很简单,并不是机械性的,但其结构可以随着新信息的出现而不断改进,也可以适当地与小尺度模型联系起来,例如间质运输模型[32],以发展多尺度运输模式。这里描述的输运分析可以通过研究不同大小的分子(即500 Da和10,000 Da)的实验数据来改进。扩散和弥散依赖于分子大小,而对流相对独立于分子大小。因此,比较不同分子大小造影剂的传输数据和参数将为对流传输与扩散或分散传输提供进一步的证据。此外,IVIM MRI数据,量化整个大脑的平均流体速度,将提高转运模型的机制复杂性。
数据和材料的可用性
支持本文结论的数据集和计算机代码可应通讯作者的合理要求提供。另外,附加文件中提供了示例代码。
缩写
- ACA:
-
大脑前动脉
- Bas:
-
底动脉
- 英国电信(BT):
-
脑组织(小动脉间质间隙和血管周围间隙)
- CM:
-
小脑延髓池
- 牛:
-
威利斯圈
- CSF:
-
beplay靠谱
- DCE-MRI:
-
动态对比增强MRI
- D:
-
自由扩散系数
- D应用程序:
-
表观扩散系数
- Ddisp:
-
弥散系数
- Deff:
-
有效扩散系数
- 有限元法:
-
有限元模型
- IVIM磁共振成像:
-
体素内非相干运动MRI
- kx:
-
Ketamine-xylazine(麻醉)
- MCA:
-
大脑中动脉
- 核磁共振成像:
-
磁共振成像
- 办公自动化:
-
嗅觉动脉
- 不是:
-
表面动脉周围空间
- 主成分分析:
-
大脑后动脉
- 体育:
-
沛克莱数
- pv:
-
血管周的空间
- rms:
-
均方根误差
- 情景应用程序:
-
蛛网膜下腔
- \ (v_ {} \):
-
间隙表面速度
- \ (v_{不是}\):
-
动脉周围空间速度
参考文献
张建军,张建军。脑细胞外空间:神经科学研究的前沿。生物学报,2017;33(4):444 - 444。https://doi.org/10.1016/j.bpj.2017.06.052.
陈志强,陈志强。淀粉样蛋白与老年痴呆症的关系。中华医学杂志,2016;8(6):595-608。https://doi.org/10.15252/emmm.201606210.
Iliff JJ, Chen MJ, Plog BA, Zeppenfeld DM, Soltero M, Yang L,等。脑外伤性损伤后淋巴通路功能损伤促进tau蛋白病理变化。中华神经科学杂志,2014;34(9):16180-93。https://doi.org/10.1523/jneurosci.3020-14.2014.
Nedergaard M,高盛淋巴功能衰竭是痴呆的最后一个常见途径。科学。2020;370(6512):50。https://doi.org/10.1126/science.abb8739.
脑组织扩散及相关转运机制。中华医学杂志,2001;64(7):815-84。https://doi.org/10.1088/0034-4885/64/7/202.
Rennels ML, Gregory TF, Blaumanis OR, Fujimoto K, Grady PA。哺乳动物中枢神经系统血管旁液体循环的证据,由蛛网膜下腔的示踪蛋白在整个大脑中的快速分布提供。中国生物医学工程学报,2010;31(1):344 - 344。https://doi.org/10.1016/0006 - 8993 (85) 91383 - 6.
Cserr HF, Depasquale M, Nicholson C, Patlak CS, Pettigrew KD, Rice ME。急性高钠血症时,大鼠脑内的细胞外体积减少,而细胞体积通过离子摄取维持。中国生物医学工程学报(英文版);2001;22(2):397 - 396。https://doi.org/10.1113/jphysiol.1991.sp018793.
李建军,王敏,廖勇,Plogg BA,彭伟,Gundersen GA,等。血管旁通路促进脑脊液通过脑实质和清除间质溶质,包括淀粉样蛋白。科学学报。2012。https://doi.org/10.1126/scitranslmed.3003748.
Iliff JJ, Wang M, Zeppenfeld DM, Venkataraman A, Plog BA,廖勇,等。脑动脉搏动驱动小鼠脑血管旁csf -间质液交换。中华神经科学杂志,2013;33(6):1819 - 1819。https://doi.org/10.1523/jneurosci.1592-13.2013.
谢磊,康宏,徐强,陈俊杰,廖勇,Thiyagarajan M,等。睡眠会促使成人大脑清除代谢物。科学。2013;342(6156):373 - 7。https://doi.org/10.1126/science.1241224.
刘建军,李建军,李建军,李建军,等。脑脊膜淋巴系统与脑淋巴系统的关系。中华临床医学杂志,2017;27(9):1210 - 129。https://doi.org/10.1172/jci90603.
Aspelund A, Antila S, Proulx ST, Karlsen TV, Karaman S, Detmar M,等。硬脑膜淋巴血管系统,排泄脑间质液和大分子。中华检验医学杂志,2015;21(7):991 - 991。https://doi.org/10.1084/jem.20142290.
尼德加德,大脑的垃圾车。科学。2013;340(6140):1529 - 30。https://doi.org/10.1126/science.1240514.
张建军,张建军,张建军,张建军。脑屏障在中枢神经系统液体运动中的作用:是否存在“淋巴”系统?中国生物医学工程学报,2018;35(3):387 - 387。https://doi.org/10.1007/s00401-018-1812-4.
Hladky SB, Barrand MA。流体进入、流经和流出大脑的机制:证据的评估。《流体屏障》,2014。https://doi.org/10.1186/2045-8118-11-26.
Smith AJ, Verkman AS。阿尔茨海默病中溶质清除的“淋巴”机制:游戏规则改变者还是未经证实的猜测?中国生物医学工程学报,2018;32(2):543-51。https://doi.org/10.1096/fj.201700999.
Mestre H, Hablitz LM, Xavier ALR,冯伟,邹伟,濮涛,等。鼠类脑中水孔蛋白-4依赖性淋巴溶质转运。Elife》2018。https://doi.org/10.7554/eLife.40070.
Mestre H, Tithof J,杜涛,宋伟,彭文文,Sweeney AM,等。脑脊液的流动由动beplay靠谱脉搏动驱动,高血压患者脑脊液流动减少。Nat common . 2018。https://doi.org/10.1038/s41467-018-07318-3.
张建军,张建军,张建军,等。脑表面血管旁空间的低阻力路径研究。beplay靠谱脑血流杂志,2018;38(4):719 - 726。https://doi.org/10.1177/0271678x17737984.
李建军,李建军,李建军,等。一类溶质转运不需要大量流动。科学代表2016。https://doi.org/10.1038/srep38635.
杨建军,李建军,李建军,等。神经系统疾病的淋巴通路研究。中华神经科杂志,2018;17(11):1016-24。https://doi.org/10.1016/s1474 - 4422 (18) 30318 - 1.
刘晓东,刘晓东,刘晓东,王晓东,等。脑衰老过程中淋巴系统和废物清除的研究进展。老年医学。2019;65(2):106 - 19所示。https://doi.org/10.1159/000490349.
Rivas FM, Liu J, Martell BC, Du T, Mestre H, Nedergaard M,等。小鼠脑动脉周围的表面间隙是开放的,而不是多孔的。J R Soc接口。2020。https://doi.org/10.1098/rsif.2020.0593.
Bilston LE, Fletcher DF, broadbelt AR, Stoodley MA。动脉搏动驱动的脑脊液在血管周围空间的流动:一个计算模型。生物医学工程学报,2003;6(4):235-41。
雷·拉,你好,JJ。脑组织中的液体流动和物质运输。液体。2019。https://doi.org/10.3390/fluids4040196.
Kedarasetti RT, Drew PJ, Costanzo F.动脉搏动驱动脑脊液振荡流,但不驱动定向泵。科学通报,2020;10(1):1 - 2。https://doi.org/10.1038/s41598-020-66887-w.
davison - catty C, Vinje V, Mardal K-A, Rognes ME。血管周围流体流动的机制。PLoS ONE。2021; 15 (12): e0244442。https://doi.org/10.1371/journal.pone.0244442.
Faghih MM, Sharp KM。示踪剂在脑血管周围空间运输的机制。中华生物医学杂志,2011;18(1):391 - 391。https://doi.org/10.1016/j.jbiomech.2021.110278.
卡斯勒埃尔。扩散:流体系统中的传质。剑桥:剑桥大学出版社;1997.
Holter KE, Kehlet B, Devor A, Sejnowski TJ, Dale AM, Omholt SW,等。三维重建神经组织中溶质运移是通过扩散而非体积流动进行的。美国国家科学促进会。2017; 114(37): 9894 - 9。https://doi.org/10.1073/pnas.1706942114.
金宝杰,Smith AJ, Verkman AS。脑细胞外空间对流溶质运输的空间模型不支持“淋巴”机制。中国生物医学工程学报,2016;48(6):489-501。https://doi.org/10.1085/jgp.201611684.
雷·L,伊利夫·JJ,嗨,JJ。脑间质对流和扩散转运的分析。液体阻碍中枢神经系统。2019; 16(1): 6。https://doi.org/10.1186/s12987-019-0126-9.
Benveniste H, Lee H, Ozturk B, Chen X, Koundal S, Vaska P,等。MRI和PET成像定量beplay靠谱测定淋巴性脑脊液和溶质转运。神经科学》2020。https://doi.org/10.1016/j.neuroscience.2020.11.014.
李俊杰,李海,于敏,冯涛,Logan J, Nedergaard M,等。磁共振增强成像捕获的全脑废物清除通路。中华临床医学杂志,2013;33(3):1299 - 1299。https://doi.org/10.1172/jci67677.
Benveniste H, Heerdt PM, Fontes M, Rothman DL, Volkow ND。淋巴系统功能与麻醉和睡眠状态的关系。生物力学学报,2019;28(4):747 - 758。https://doi.org/10.1213/ane.0000000000004069.
Gakuba C, Gaberel T, Goursaud S, Bourges J, Di Palma C, Quenault A,等。全身麻醉抑制“淋巴系统”的活动。开展。2018;8(3):710 - 22所示。https://doi.org/10.7150/thno.19154.
Dobson H, Sharp MM, Cumpsty R, Criswell TP, Wellman T, Finucane C,等。脑脊液流入的血管周围通路在中脑最为有效。beplay靠谱临床医学杂志,2017;31(22):2745-52。https://doi.org/10.1042/cs20171265.
刘建军,刘建军,刘建军,等。非人灵长类动物蛛网膜下腔出血严重损害脑实质脑脊液循环。beplay靠谱中风。2017年,48(8):2301。https://doi.org/10.1161/strokeaha.117.017014.
姜强,张磊,丁国良,Davoodi-Bojd E,李启军,李磊,等。糖尿病后淋巴系统的损害。脑血流杂志,2017;37(4):1326 - 1337。https://doi.org/10.1177/0271678x16654702.
周勇,蔡建生,张文辉,龚XX,闫思平,张康明,等。衰老人类中淋巴通路和脑膜淋巴管的损伤。神经神经学报,2020;31(3):357-69。https://doi.org/10.1002/ana.25670.
皮佐ME, Wolak DJ, Kumar NN, Brunette E, Brunnquell CL, Hannocks M-J,等。大鼠脑鞘内抗体分布:表面扩散、血管周围转运和渗透增强传递。中国生物医学工程学报,2018;35(3):445 - 475。https://doi.org/10.1113/jp275105.
Koundal S, Elkin R, Nadeem S, Xue YC, Constantinou S, Sanggaard S,等。拉格朗日工作流的最佳质量传输揭示了淋巴系统中平流和扩散驱动的溶质传输(vol 10, 1990,2020)。科学众议员2020。https://doi.org/10.1038/s41598-020-60586-2.
Valnes LM, Mitusch SK, Ringstad G, Eide PK, Funke SW, Mardal K-A。基于24小时示踪剂运动支持脑皮质淋巴运输的表观扩散系数估计。科学通报,2020;10(1):976。https://doi.org/10.1038/s41598-020-66042-5.
Ringstad G, Valnes LM, Dale AM, Pripp AH, Vatnehol SAS, Emblem KE,等。MRI评估人类全脑淋巴增强和清除。Jci洞察,2018。https://doi.org/10.1172/jci.insight.121537.
Ringstad G, Vatnehol SAS, Eide PK.特发性正常压力脑积水的淋巴MRI。大脑。2017;140:2691 - 705。https://doi.org/10.1093/brain/awx191.
Tithof J, Kelley DH, Mestre H, Nedergaard M, Thomas JH。脑动脉周围间隙的水力阻力。《流体屏障》,2019。https://doi.org/10.1186/s12987-019-0140-y.
大流量在血管周围、血管旁和静脉旁通道是否合理?流体防护学报,2018。https://doi.org/10.1186/s12987-018-0103-8.
Rattanakijsuntorn K, Penkova A, Sadhal SS, Iop。用FEM和MRI测量玻璃体间质扩散系数。第八届机械工程国际学术会议。材料科学与工程学报,2018,2972018。
张建军,张建军。脑细胞外空间弥散的研究进展。中国生物医学工程学报,2008;38(4):1277 - 1240。https://doi.org/10.1152/physrev.00027.2007.
巴克利DL,帕克GJM。在t1加权动态增强MRI中测量造影剂浓度。In: Jackson A, Buckley DL, Parker GJM,编辑。动态对比增强磁共振成像在肿瘤中的应用。柏林,海德堡:Springer Berlin Heidelberg;2005.p . 69 - 79。
Szomolanyi P, Rohrer M, Frenzel T, Noebauer-Hohmann IM, Jost G, Endrikat J,等。大环钆造影剂在1.5 T、3 T和7t时血浆和3t时血液松弛度的比较。中华放射医学杂志,2019;54(9):559-64。https://doi.org/10.1097/rli.0000000000000577.
张建军,张建军,张建军,等。磁共振成像中不同角度T-1重建的实用方法。算法计算技术[J] . 2016;10(4): 213-23。https://doi.org/10.1177/1748301816656288.
罗登C. MRIcroS。MATLAB中心文件交换:神经成像工具和资源协作。
Cignoni P, Callieri M, Corsini M, Dellepiane M, Ganovelli F, Ranzuglia G. MeshLab:三维三角形网格的处理和编辑。天体物理源代码库。2017。
格赞恩C,雷米克J-F。一个三维有限元网格生成器,内置预处理和后处理设施。国际数字医学学报,2009;39(11):1309 - 1309。https://doi.org/10.1002/nme.2579.
Logg AM, Mardal KA, Wells GN。用有限元法自动解微分方程:FEniCS书。柏林:施普林格;2012.
logaw, GN;Hake J. DOLFIN: c++ /Python有限元库。计算科学与工程课堂讲稿。中文:用有限元法自动求解微分方程。柏林:施普林格;2012.
Van Rossum GD, FL. Python 3参考手册。加利福尼亚州斯科特谷:CreateSpace;2009.
allen JG, B: Law, C. Paraview:一个面向大数据可视化的终端用户工具,可视化手册。爱思唯尔;2005.
张建军,张建军,张建军,等。大鼠脑内的血管旁通道、池和蛛网膜下腔:具有优先通路的单一腔室。脑血流杂志,2017;37(4):1374 - 1385。https://doi.org/10.1177/0271678x16655550.
Lochhead JJ, Wolak DJ, Pizzo ME, Thorne RG。鼻内给药后,在脑血管周围空间内的快速运输是示踪剂在脑内广泛分布的基础。脑血流杂志,2015;35(3):371-81。https://doi.org/10.1038/jcbfm.2014.215.
Harrison IF, Siow B, Akilo AB, Evans PG, Ismail O, Ohene Y,等。利用弥散张量MRI评估血管周围液体运动对csf介导的脑清除通路的无创成像。Elife》2018。https://doi.org/10.7554/eLife.34028.
斯沃茨硕士,弗勒里硕士。软组织间质流动及其影响。生物医学工程学报,2007;9(2):229 - 56。https://doi.org/10.1146/annure/bioeng.9.060906.151850.
Plog BA, Mestre H, Olveda GE, Sweeney AM, Kenney HM, Cove A,等。经颅光学成像揭示了优化免疫治疗药物到大脑的途径。Jci洞察,2018。https://doi.org/10.1172/jci.insight.120922.
Lundgaard I, Lu ML, Yang E, Peng W, Mestre H, Hitomi E,等。淋巴清除控制脑乳酸浓度的状态依赖性变化。脑血流杂志,2017;37(6):2112-24。https://doi.org/10.1177/0271678x16661202.
李宏,谢磊,于敏,康宏,冯涛,Deane R,等。体位对脑淋巴转运的影响。神经科学学报,2015;35(31):11034-44。https://doi.org/10.1523/JNEUROSCI.1625-15.2015.
李海,Mortensen K, Sanggaard S, Koch P, Brunner H, Quistorff B,等。使用3D VFA-SPGR在9.4T时定量从脑脊液中摄取Gd-DObeplay靠谱TA到大鼠脑。中华医学杂志,2018;39(3):1568 - 1578。https://doi.org/10.1002/mrm.26779.
丁刚,Chopp M,李磊,张磊,Davoodi-Bojd E,李强,等。Gd-DTPA输注率对淋巴反应的MRI研究。中国生物医学工程学报,2018;39(6):591 - 591。https://doi.org/10.1002/jnr.24325.
Davoodi-Bojd E,丁国良,张磊,李启军,李磊,Chopp M,等。脑淋巴系统的MRI建模。科学杂志。2019;188:616-27。https://doi.org/10.1016/j.neuroimage.2018.12.039.
Hablitz LM, Vinitsky HS, Sun Q, Stæger FF, Sigurdsson B, Mortensen KN,等。在麻醉小鼠中,淋巴内流增加与高EEG δ功率和低心率相关。科学通报,2019;5(2):851 - 851。https://doi.org/10.1126/sciadv.aav5447.
Stanton EH, Persson N, Gomolka RS, Lilius T, sigur & sson B, Lee H,等。使用高时空分辨率动态对比增强MRI绘制小鼠脑脊液运输图:麻醉的影响。中华医学杂志;2009;35(6):326 - 326。https://doi.org/10.1002/mrm.28645.
Fultz NE, Bonmassar G, Setsompop K, Stickgold RA, Rosen BR, Polimeni JR,等。人睡眠中的电生理、血流动力学和脑脊液振荡耦合。beplay靠谱科学。2019;366(6465):628 - 31所示。https://doi.org/10.1126/science.aax5440.
Paschoal AM, Leoni RF, Dos Santos AC, Paiva FF。神经和脑血管疾病的体素内非相干运动MRI。神经影像杂志,2018;20:705-14。https://doi.org/10.1016/j.nicl.2018.08.030.
薛毅,刘霞,Koundal S, Constantinou S, Dai F, Santambrogio L,等。体内T1定位定量淋巴系统运输和颈部淋巴结引流。科学通报,2020;10(1):1 - 4。https://doi.org/10.1038/s41598-020-71582-x.
Raghunandan A, Ladron-de-Guevara A, Tithof J, Mestre H, Du T, Nedergaard M,等。在动脉周围间隙观察到的大量beplay靠谱脑脊液流动不是注射的伪影。Elife》2021。https://doi.org/10.7554/eLife.65958.
设计与进化的构造法则:物理学、生物学、技术与社会。应用物理学报。2013。https://doi.org/10.1063/1.4798429.
Reis AH, Miguel AF, Aydin M.肺流动结构的构造理论。中华医学杂志,2004;31(5):1135-40。https://doi.org/10.1118/1.1705443.
资金
JH和LR得到NSF (DMS-1361240)的部分支持。
作者信息
作者及单位
贡献
JH和LR构思和设计了这项研究;LR进行了模拟并分析了结果;MS和MP进行DCE-MRI实验,对DCE-MRI数据进行后处理和配准;MP提供了有关MRI实验和数据的宝贵知识;JI提供了有关神经生理学的宝贵知识;LR根据其他作者的意见撰写了这篇文章。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
beplay體育施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
雷,洛杉矶,派克,西蒙,M。et al。大鼠脑内宏观溶质运输的定量分析。流体屏障18, 55(2021)。https://doi.org/10.1186/s12987-021-00290-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12987-021-00290-z
关键字
- Biotransport
- 大脑传输
- Glymphatic
- 血管周的运输
- 间质运输
- 动态对比增强MRI